Le trifluorure de brome est un composé interhalogène toxique. Il est connu pour ses utilisations comme agent de fluoration puissant.
Identification du trifluorure de brome
Numéro CAS: 7787-71-5
Numéro ONU: UN1746
Numéro de référence du composé PubChem: 24594
Numéro de référence ChemSpider: 20474213
Numéro MDL: MFCD00042533
Numéro CE: 232-132-1
Numéro RTECS: ED2275000
InChI Identifiant: InChI = 1S / BrF3/c2-1(3)4
Clé InChI: InChIKey = FQFKTKUFHWNTBN-UHFFFAOYSA-N
Formule chimique du trifluorure de brome
La formule chimique de ce composé interhalogène est BrF3.
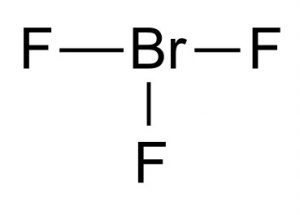
Image 1 – trifluorure de brome
Production de trifluorure de brome
En 1906, Paul Lebeau synthétise ce composé pour la première fois en faisant réagir du brome avec du fluor à une température de 20 ° C. La réaction est représentée par l’équation suivante:
Br2 + 3F2 → 2BrF3
Une autre façon de produire du trifluorure de brome consiste à réduire et à oxyder simultanément le monofluorure de brome. Cette réaction produit du trifluorure de brome et du brome.
3BrF → BrF3 + Br2
Composition de trifluorure de brome
Le trifluorure de brome est composé de 58,367% de brome et de 41,632% de fluor.
Propriétés du trifluorure de brome
Les propriétés physiques et chimiques de cette substance sont discutées ci-dessous:
Apparence
C’est un liquide de couleur paille.
Odeur
Le produit chimique a une odeur piquante.
Hygroscopie
C’est un liquide hygroscopique.
Masse molaire
La masse molaire du trifluorure de brome est de 136,90 g / mol.
Masse monoisotopique
La masse monoisotopique de cette substance est de 135,913547 u (unités de masse atomique unifiées).
Densité
La densité de la substance est de 2,803 g / cm3.
Point de fusion
Le point de fusion du trifluorure de brome est de 8,77 ° C.
Point d’ébullition
Le point d’ébullition de cette substance est de 125,72 ° C.
Conductivité
En raison de l’autoionisation, le liquide est un bon conducteur d’électricité.
Corrosivité
C’est un liquide corrosif.
Densité
La densité du trifluorure de brome est de 2,81 à une température de 68,0 ° F.
Moment dipolaire
Le moment dipolaire moléculaire de cette substance est de 1,19 Debye.
Solubilité
Le trifluorure de brome est soluble dans l’acide sulfurique. Il se décompose et explose lorsqu’il entre en contact avec des composés organiques et de l’eau. Les réactions avec des composés contenant de l’hydrogène peuvent provoquer des réactions violentes. De nombreux fluorures ioniques se dissolvent facilement dans le trifluorure de brome et forment des solvobases.
KF + BrF3 → KBrF4
Outre les propriétés mentionnées ci-dessus, le trifluorure de brome est également un puissant agent fluorant.
Structure du trifluorure de brome
La structure de Lewis du trifluorure de brome montre qu’il a une structure moléculaire en forme de T. Selon la théorie de la formation moléculaire VSEPR, le brome central est connecté à deux paires d’électrons. La distance entre le centre de brome et le fluor équatorial est de 1,72 Å et à chacun du fluor axial est de 1,81 Å. L’angle entre le fluor équatorial et un fluor axial est de 86,2°. L’angle est maintenu légèrement inférieur à 90 ° car la force de répulsion des liaisons Br-F est inférieure à la force des paires d’électrons.
Réactions au trifluorure de brome
Le trifluorure de brome lors de la réaction avec les oxydes métalliques donne de l’oxygène. Lorsque le trifluorure de brome réagit avec le dioxyde de silicium, il produit du tétrafluorure de silicium gazeux et du brome.
Dans une réaction entre le trifluorure de brome et l’oxyde de titane (IV), le fluorure de titane (IV) et le brome sont produits.
Utilisations du trifluorure de brome
Le trifluorure de brome est un solvant inorganique ionisant puissant et un agent de fluoration. Il est également utilisé pour la fabrication d’hexafluorure d’uranium (UF6) lors du traitement et du retraitement du combustible nucléaire.
Fiche signalétique du trifluorure de brome
Risques pour la santé
Un être humain exposé au trifluorure de brome peut souffrir des problèmes de santé suivants:
Contact avec la peau: Le contact cutané avec ce produit chimique peut entraîner des sensations de brûlure et d’irritation.
Contact avec les yeux: Si les yeux entrent en contact avec les vapeurs chimiques ou le produit chimique lui-même, cela peut entraîner de graves brûlures des yeux, des ulcères et même la cécité.
Ingestion: L’ingestion entraîne une brûlure sévère des muqueuses.
Inhalation: L’inhalation peut entraîner une irritation sévère du système respiratoire supérieur.
Premiers soins
Yeux: Les yeux doivent être soigneusement lavés à grande eau pendant au moins 15 minutes. Un médecin doit être consulté immédiatement.
Peau: Si la peau entre en contact avec le produit chimique, les zones infectées doivent être bien lavées à l’eau et au savon pendant au moins 15 minutes. Des soins médicaux immédiats sont nécessaires. Les vêtements contaminés doivent être retirés rapidement. Les vêtements doivent être soigneusement nettoyés et séchés avant d’être réutilisés. Les chaussures contaminées doivent être détruites.
Ingestion: En cas d’ingestion accidentelle, la victime doit boire beaucoup d’eau. Provoquer des vomissements n’est pas recommandé.
Inhalation: En cas d’effets indésirables, la victime doit être emmenée dans une zone non contaminée. La respiration artificielle doit être appliquée au cas où la victime ne respirerait pas. Si la respiration et la respiration sont encore difficiles, de l’oxygène doit être administré. Une assistance médicale supplémentaire est nécessaire pour assurer la sécurité de la victime.
Profil de réactivité
Le trifluorure de brome est un agent oxydant hautement réactif. Il réagit violemment lorsqu’il entre en contact avec l’eau. Il peut accélérer la combustion d’une substance combustible. Lorsqu’il entre en contact avec des substances contenant de l’hydrogène telles que l’acide acétique, l’ammoniac et le méthane, il peut provoquer une explosion et un incendie. Il réagit également violemment avec les acides, les halogènes, les halogénures métalliques, les métaux et les oxydes métalliques à température ambiante. Il provoque spécifiquement des réactions dangereuses avec l’acide nitrique, l’acide sulfurique, l’iode et le sélénium.
Mesures de lutte contre l’incendie
Le trifluorure de brome est un agent oxydant et peut donc s’enflammer ou exploser lorsqu’il entre en contact avec des combustibles.
En cas d’incendie important, la zone doit être isolée et inondée d’eau à une distance de sécurité. Si les récipients contenant du trifluorure de brome sont près du feu, ils devraient être retirés si cela pouvait être fait en toute sécurité. Les récipients doivent être refroidis à l’eau courante même longtemps après l’extinction du feu.
Moyens d’extinction d’incendie: Des moyens d’extinction d’incendie appropriés doivent être utilisés tout en éteignant le feu. L’utilisation d’eau, de produits chimiques secs ou de carbonate de sodium est recommandée pour éteindre le feu.
Mesures de rejet accidentel
Les matériaux combustibles doivent être isolés et toute connexion avec eux doit être évitée. Le matériau renversé ne doit pas être touché. Les fuites chimiques doivent être arrêtées s’il est possible de le faire sans risque personnel. La prévalence des vapeurs chimiques devrait être réduite avec un jet d’eau. Il faut veiller à ne pas introduire d’eau à l’intérieur des contenants de produits chimiques. Pour les déversements importants, les produits chimiques doivent être mis en quarantaine pour être éliminés plus tard. La zone doit être ventilée correctement.
Manipulation du trifluorure de brome
La manipulation de ce matériau est soumise aux réglementations de manutention en vertu de l’OSHA 29 CFR 1910.119 des États-Unis.
Stockage du trifluorure de brome
Le produit chimique doit être stocké et manipulé conformément aux normes et réglementations en vigueur du Code NFPA 430 pour le stockage des Matières oxydantes liquides et solides. Les contenants de produits chimiques doivent être protégés contre tout type de dommage physique. Ils doivent également être tenus à l’écart de toute substance incompatible.
Protection individuelle
Lors de la manipulation de ce produit chimique, une protection adéquate doit être prise. Un équipement de protection approprié doit être utilisé. Ceux-ci devraient idéalement inclure:
- Un appareil respiratoire autonome MSHA / NIOSH (approuvé ou équivalent) doté de masques à oxygène à pression est requis pour une respiration correcte.
- Des lunettes de protection ou des lunettes de sécurité approuvées par l’OSHA sont nécessaires pour protéger les yeux.
- Pour protéger la peau des infections nocives résultant d’un contact chimique, des vêtements de protection et des gants doivent être utilisés.
Outre l’équipement de protection mentionné ci-dessus, la zone doit également être bien ventilée. Le mécanisme de ventilation doit être résistant aux explosions en cas de présence de concentrations explosives du produit chimique. Un système d’échappement local devrait également être fourni.