Brom trifluorid er en giftig interhalogenforbindelse. Det er kjent for sin bruk som et sterkt fluoriserende middel.
Identifikasjon av bromtrifluorid
CAS-Nummer: 7787-71-5
FN-Nummer: UN1746
PubChem Sammensatt ID: 24594
ChemSpider Referansenummer: 20474213
MDL-nummer: MFCD00042533
EC-Nummer: 232-132-1
RTECS-Nummer: ED2275000
InChI Identifikator: InChI = 1s / BrF3 / c2-1(3)4
InChI Nøkkel: InChIKey=FQFKTKUFHWNTBN-UHFFFAOYSA-N
Kjemisk Formel For bromtrifluorid
kjemisk formel for denne interhalogenforbindelsen Er BrF3.
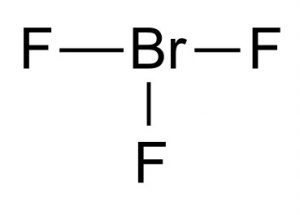
Bilde 1 – brom trifluorid
Produksjon Av brom trifluorid
I år 1906 syntetiserte Paul Lebeau Denne forbindelsen for første gang ved å reagere brom med fluor ved en temperatur På 20°C. reaksjonen er representert ved følgende ligning:
Br2 + 3f2 → 2BrF3
En annen måte å produsere bromtrifluorid på er samtidig å redusere Og oksidere Brommonofluorid. Denne reaksjonen produserer bromtrifluorid og brom.
3BrF → BrF3 + Br2
Sammensetning Av bromtrifluorid
bromtrifluorid består av 58,367% brom og 41,632% fluor.
Egenskaper Av bromtrifluorid
de fysiske og kjemiske egenskapene til dette stoffet er omtalt nedenfor:
Utseende
det er en stråfarget væske.
Lukt
kjemikaliet har en skarp lukt.
Hygroskopi
det er en hygroskopisk væske.
Molarmasse
den molare massen Av bromtrifluorid er 136,90 g/mol.
Monoisotopisk Masse
den monoisotopiske massen av dette stoffet er 135.913547 u (enhetlige atommasseenheter).
Tetthet
tettheten av stoffet er 2,803 g / cm3.
Smeltepunkt
smeltepunktet For bromtrifluorid er 8.77°C.
Kokepunkt
kokepunktet for dette stoffet Er 125.72°C.
Konduktivitet
på grunn av autoionisering er væsken en god leder av elektrisitet.
Korrosjon
Det er en korrosiv væske.
Spesifikk vekt
spesifikk vekt Av bromtrifluorid er 2,81 ved en temperatur på 68,0°F.
Dipolmoment
molekylært dipolmoment av dette stoffet er 1,19 Debye.
Oppløselighet
bromtrifluorid er oppløselig i svovelsyre. Den dekomponerer og eksploderer når den kommer i kontakt med organiske forbindelser og vann. Reaksjoner med hydrogenholdige forbindelser kan forårsake voldelige reaksjoner. Mange ioniske fluorider oppløses lett i bromtrifluorid og danner solvobaser.
KF + BrF3 → KBrF4
Bortsett fra de ovennevnte egenskapene, Er bromtrifluorid også et kraftig fluoriserende middel.
Struktur Av bromtrifluorid
Lewis-strukturen av bromtrifluorid viser at den har En t-formet molekylær struktur. IFØLGE vsepr-teorien om molekylær dannelse er den sentrale brom forbundet med to elektronpar. Avstanden mellom brom sentrum og ekvatorialfluoren er 1.72 Å og til hver av det aksiale fluor er 1.81 Å. Vinkelen mellom ekvatorialfluorin og aksialfluorin er 86,2° Vinkelen holdes litt mindre enn 90° da frastøtningskraften fra Br-F-bindingene er lavere enn kraften til elektronparene.
Bromtrifluoridreaksjoner
bromtrifluorid ved reaksjon med metalloksider gir oksygen. Når bromtrifluorid reagerer med silisiumdioksyd, produserer det gassformig silisiumtetrafluorid og brom.
i en reaksjon mellom bromtrifluorid og titan(IV) oksid, produseres titan(IV) fluor og brom.
bromtrifluorid Bruker
bromtrifluorid er et sterkt ioniserende uorganisk løsningsmiddel og et fluoriserende middel. Det brukes også til produksjon av uranheksafluorid (UF6) under behandling og reprosessering av atombrensel.
BROMTRIFLUORID MSDS
Helsefare
et menneske som er utsatt For bromtrifluorid kan lide av følgende helseproblemer:
Hudkontakt: Hudkontakt med dette kjemikaliet kan føre til brennende og irriterende følelser.
Øyekontakt: hvis øynene kommer i kontakt med kjemiske damper eller kjemikaliet selv, kan det føre til alvorlig brenning av øynene, sår og til og med blindhet.
Svelging: Inntak fører til alvorlig forbrenning av slimhinnene.
Innånding: Innånding kan føre til alvorlig irritasjon i øvre luftveier.
Førstehjelpstiltak
Øyne: øynene må vaskes grundig med mye vann i minst 15 minutter. En lege må konsulteres umiddelbart.
Hud: hvis huden kommer i kontakt med kjemikaliet, skal de infiserte områdene vaskes godt med vann og såpe i minst 15 minutter. Øyeblikkelig legehjelp er nødvendig. Forurensede klær må fjernes raskt. Klærne skal rengjøres grundig og tørkes før gjenbruk. De forurensede skoene skal ødelegges.
Svelging: ved utilsiktet inntak skal offeret drikke rikelig med vann. Induserende oppkast anbefales ikke.
Innånding: I tilfelle eventuelle bivirkninger, skal offeret tas til et uforurenset område. Kunstig åndedrett må brukes dersom offeret ikke puster. Hvis pust og respirasjon fortsatt er vanskelig, bør oksygen administreres. Ytterligere medisinsk hjelp er nødvendig for å sikre offerets sikkerhet.
Reaktivitetsprofil
bromtrifluorid er et svært reaktivt oksidasjonsmiddel. Det reagerer voldsomt når det kommer i kontakt med vann. Det kan akselerere brenningen av et brennbart stoff. Når det kommer i kontakt med hydrogenholdige stoffer som eddiksyre, ammoniakk og metan, kan det forårsake eksplosjon og brann. Det reagerer også voldsomt med syrer, halogener, metallhalogenider, metaller og metalloksider ved romtemperatur. Det forårsaker spesielt farlige reaksjoner med salpetersyre, svovelsyre, jod og selen.
Brannslokkingstiltak
bromtrifluorid er et oksidasjonsmiddel og Kan derfor antennes eller eksplodere når det kommer i kontakt med brennbare stoffer.
ved store branner skal området isoleres og oversvømmes med vann fra sikker avstand. Hvis beholdere som lagrer bromtrifluorid er nær brann, bør de fjernes hvis det kan gjøres trygt. Beholderne skal avkjøles med rennende vann selv lenge etter at brannen er slukket.
Brannslukningsmedium: Riktig brannslukningsmedium må brukes mens du setter av brann. Bruk av vann, tørr kjemisk eller soda anbefales for slukning av brann.
Tiltak Ved Utilsiktet Utslipp
de brennbare materialene skal isoleres og enhver forbindelse med dem bør unngås. Det spylte materialet bør ikke berøres. Kjemisk lekkasje bør stoppes hvis det er mulig å gjøre det uten personlig risiko. Utbredelsen av kjemiske damper bør reduseres med vannspray. Det må tas hensyn til ikke å få vann inne i kjemiske beholdere. For store utslipp bør kjemikaliene settes i karantene for å avhendes senere. Området skal ventileres ordentlig.
Håndtering Av bromtrifluorid
Håndtering av dette materialet er underlagt håndteringsforskrifter under U. S. OSHA 29 CFR 1910.119.
Lagring Av bromtrifluorid
kjemikaliet skal lagres og håndteres i henhold til gjeldende standarder OG forskrifter I NFPA 430-Koden for lagring Av Flytende Og Faste Oksidasjonsmaterialer. De kjemiske beholderne skal beskyttes mot enhver form for fysisk skade. De bør også holdes vekk fra eventuelle inkompatible stoffer.
Personlig Beskyttelse
ved håndtering av dette kjemikaliet må det tas tilstrekkelig beskyttelse. Riktig beskyttelsesutstyr skal brukes. Disse bør ideelt sett omfatte:
- MSHA / NIOSH (godkjent eller tilsvarende) selvstendig pusteapparat med trykkbehov oksygenmasker er nødvendig for riktig respirasjon.
- OSHA-godkjente vernebriller eller vernebriller er nødvendig for å beskytte øynene.
- for å beskytte huden mot skadelige infeksjoner som følge av kjemisk kontakt, bør verneklær og hansker brukes.
bortsett fra ovennevnte beskyttelsesutstyr, bør området også være godt ventilert. Ventilasjonsmekanismen skal være motstandsdyktig mot eksplosjoner i tilfelle eksplosive konsentrasjoner av kjemikaliet er tilstede. Et lokalt eksosanlegg bør også leveres.