Fluorescensspektroskopi
Fluorescensspektroskopi bruges rutinemæssigt til at studere strukturelle ændringer i konjugerede systemer, aromatiske molekyler og stive, plane forbindelser på grund af ændringer i temperatur, pH, ionstyrke, opløsningsmiddel og ligander. En enkelt fluorofor kan generere tusinder af detekterbare fotoner, der gentagne gange kan ophidses og detekteres, hvilket gør fluorescensspektroskopi en meget følsom teknik.
fluorescens er en type strålingsemission, der opstår, når et molekyle absorberer energi ved en bølgelængde, hvor det har et overgangsdipolmoment. Den eksitationsenergi, der leveres til molekylet ved jordtilstanden, fremmer fotoner til en ophidset singlettilstand, hvor de derefter henfalder til det laveste vibrationsenerginiveau i denne ophidsede singlettilstand. Denne energi slapper yderligere tilbage til molekylets jordtilstand og udsender fotoner i processen, som vist i Figur 1.
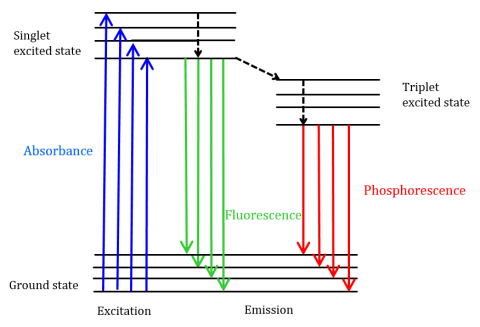
fluorescerende molekyler kan også gennemgå der er tre metoder til ikke-radioaktiv afslapning, hvor eksitationsenergien ikke omdannes til fotoner: (1) intern konvertering, (2) ekstern konvertering og (3) krydsning mellem systemet. Intern konvertering opstår, når der er et relativt lille energigab mellem to elektroniske tilstande og elektronerne overgang fra en højere elektronisk tilstand til en med lavere energi. Her overføres energien til den elektroniske tilstands vibrationsformer. Da vibrationsprocesser er termisk drevet, fører stigende temperatur til fald i fluorescensintensitet. Ved ekstern konvertering går energi tabt gennem kollisionshærdning med opløste molekyler i fluoroforens miljø. Intersystemkrydsning opstår, når vibrationsniveauer af singlet-og triplet-ophidsede tilstande overlapper hinanden i energi-og elektronovergangen fra den laveste singlet-ophidsede tilstand til den første ophidsede triplet-tilstand. De fotoner, der udsendes, når de vender tilbage til jordtilstanden, er kendt som phosphorescens (Figur 1). Triplettilstanden er lavere i energi end singlettilstanden, så phosphorescenstoppe findes ved længere bølgelængder end fluorescens. Da disse overgange også er forbudt, udviser phosphorescens en længere levetid (~10-4 – 102 sekunder) sammenlignet med fluorescens (~10-9 – 10-6 sekunder). De længere levetider fører også til termisk deaktivering via iltslukning, opløsningsmiddelbevægelse og intermolekylær kollision, så phosphorescens typisk ikke kan observeres ved stuetemperatur, og prøver skal derfor afkøles ved flydende nitrogentemperatur.
ølens lov og Koncentrationseffekter
mens absorption sker på tidsskalaen på mindre end 10-15 sekunder, er afslapningsprocessen fra ophidset til jordtilstand meget langsommere. Derfor kan fluorescens give information om en fluorophores interaktioner med omgivende molekyler og opløsningsmidler, i modsætning til absorption.
Fluorescensintensitet er direkte proportional med eksitationslysintensiteten
F=2.303 * K * I0 * ebc
hvor K er en konstant baseret på instrumentgeometri, I0 er intensiteten af eksitationslyset, e er fluorophorens molære absorptivitet, b er pathlength, og c er koncentrationen. Da fluorescensintensiteten ikke er relateret til den indfaldende lysintensitet som med absorptionsmålinger, er fluorescensfølsomheden meget større, fordi den ikke er begrænset af instrumenternes evne til at skelne mellem hændelsen og detekterede intensiteter. Derfor kræves der mindre koncentrationer til målinger.
ovenstående ligning er kun lineær, når prøveabsorbansen er mindre end 0,05 AU. Hvis en prøve er for koncentreret, kan emissionslyset reabsorberes af fluoroforen, hvilket dæmper fluorescenssignalet ved kortere bølgelængder. Eksitationslys kan heller ikke helt trænge ind i den fulde bredde af en stærkt koncentreret prøve, hvilket også vil føre til nedsatte fluorescensintensiteter.
instrumentering af Fluorescensspektroskopi
karakteristika for et Fluorescensspektrum
Fluorometre er sammensat af en eksitations-og emissionsmonokromator, der giver brugerne mulighed for at opnå både eksitations-og emissionsspektre. En måling foretaget af et fluorometer er unik for det enkelte Instruments eksitation og emission monokromatorer. Fluorescens er direkte relateret til lysstrøm og effektiviteten af måling og er derfor afhængig af instrumentets design og komponenter såsom lyskilden, monokromatoroptik og fotomultiplikatorrør. Hver lyskilde har en anden spektraludgang (både form og effekt), som vil variere og falde i løbet af kildens levetid.
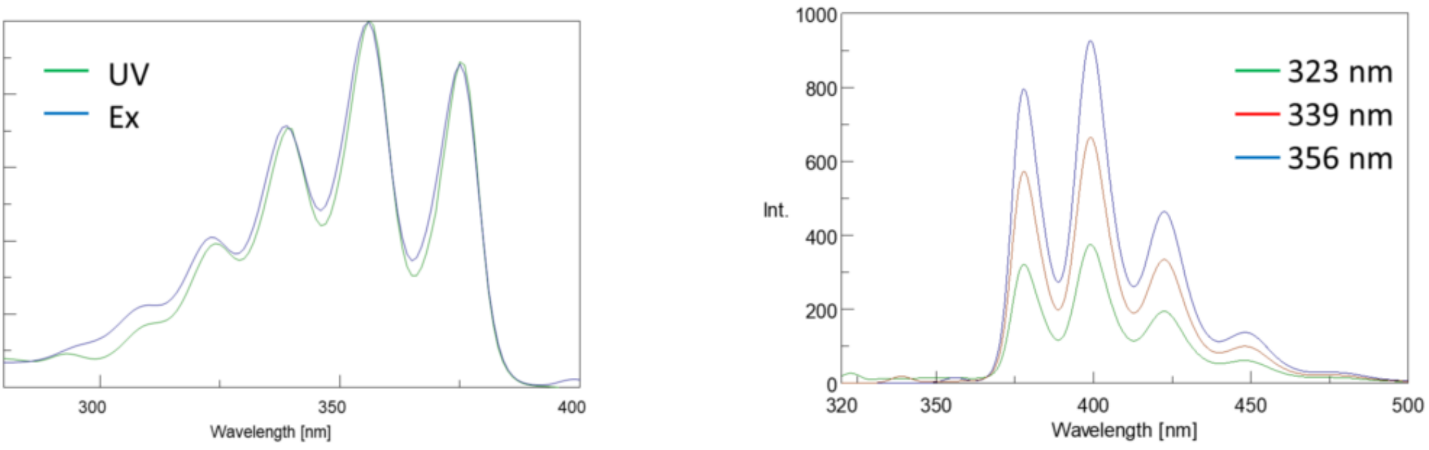
Eksitationsspektre tegner intensiteten ved en fast emissionsbølgelængde, mens de varierer eksitationsbølgelængderne. Da de fleste emissionsspektre er uafhængige af eksitationsbølgelængden, er eksitationsspektre ofte duplikater af fluorophores absorptionsspektrum.
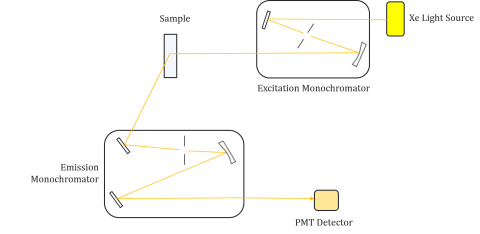
omvendt viser et emissionsspektrum intensiteten ved en fast eksitationsbølgelængde under scanning gennem varierende emissionsbølgelængder. Disse emissionsscanninger giver information om fluoroforens molekylære struktur og det lokale miljø, der omgiver det. Da fluorescensemissionen altid forekommer fra den laveste ophidsede tilstand til jordtilstanden, er formen på emissionsspektret uafhængig af eksitationsbølgelængden. Der kræves også mere energi for at ophidse et molekyle fra jorden til den ophidsede tilstand, hvilket resulterer i emissionstoppe ved længere bølgelængder (dvs.mindre energier) end deres tilsvarende eksitationsbølgelængder. Denne forskel i energi mellem ophidselses-og emissionsbølgelængderne er kendt som Stokes-skiftet.
derudover er absorptions-og emissionsspektre ofte spejlbilleder af hinanden på grund af den lige fordeling mellem vibrationsenerginiveauerne i de ophidsede og jordtilstande (figur 3). Franck-Condon-princippet forklarer, at fordi kernerne er relativt store, og den elektroniske overgang, der er involveret i emission og absorption, forekommer på så hurtige tidsskalaer, er der ingen tid for kerner at bevæge sig og vibrationsenerginiveauerne og forbliver derfor stort set de samme gennem den elektroniske overgang.
spektral båndbredde
da fluorescensintensiteten er proportional med indgangslysintensiteten, vil mængden af lys, der føres gennem monokromatoren, i høj grad påvirke intensiteten. Summen af spændings-og emissionsbåndbredderne skal være omkring spektral båndbredde (SBV) for toppen, der overvåges, så alle toppe er godt løst. Så længe denne tommelfingerregel følges, kan båndbredderne åbnes for at øge mængden af lys gennemstrømning for prøver med lav fluorescens. Den kan også blive påvirket af Stokes-skiftet af fluoroforen. Smallere Stokes-skift kan begrænse rækkevidden af acceptable SBU ‘ er, der kan bruges.
Fluorescensartefakter
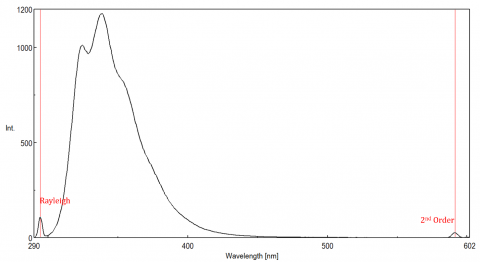
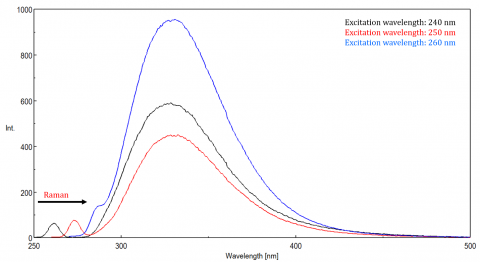
spredt lys kan give anledning til artefakter, der forvrænger fluorescensspektret. De tre mest almindelige typer scatter set i fluorescens er Rayleigh, 2.orden og Raman scatter (figur 3). Rayleigh-spredning er det spredte eksitationslys og topper derfor ved eksitationsbølgelængden. 2. ordens scatter er højere ordens scatter observeret ved to gange eksitationsbølgelængden. Raman-spredning er uelastisk spredning på grund af opløsningsmidler og toppe ved en fast energi fra eksitationsbølgelængden. For at differentiere Raman-spredning fra en fluorescenstop kan eksitationsbølgelængden varieres i trin på 5 til 10 nm, og hvis den pågældende top skifter med eksitationsbølgelængden og falder i intensitet, skyldes denne top Raman-spredning. Du kan også kontrollere, om toppen er i det tomme opløsningsmiddelspektrum. Hvis det er, er der en chance for, at det er en Raman-top. Hvis fluorescenstoppen er for tæt eller overlapper med enten Raman-eller Rayleigh-spredningen, kan båndbredderne og/eller eksitationsbølgelængden justeres for at flytte spredningen fra fluorescenstoppen. Disse virkninger er mest fremtrædende for meget lave fluoroforkoncentrationer og især stærkt spredende opløsninger, som proteiner, mikrosfære, nanopartikler såvel som faste stoffer.
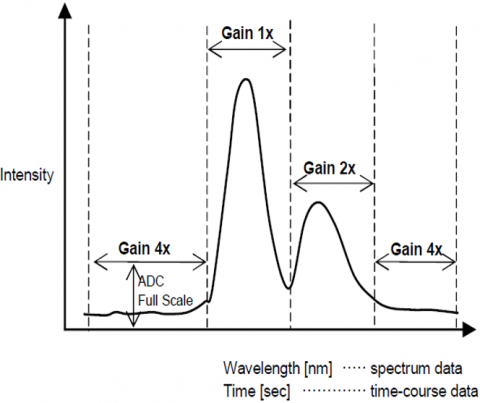
dynamisk område
den automatiske Forstærkningskontrolfunktion justerer automatisk forstærkningen af et signal fra detektoren baseret på fluorescensintensiteten. Dette optimerer signalet til støj i hele det scannede område til spektral-eller tidsforløbsmålinger, så toppe med forskellige intensiteter automatisk justeres for at forbedre S/N og sikre resultatnøjagtighed.
automatisk Følsomhedsstyringssystem (SCS)
det automatiske Følsomhedsstyringssystem(SCS) udvider det detekterede fluorescenssignals dynamiske område ved automatisk at justere detektorspændingen i henhold til fluorescensintensiteten. Dette giver mulighed for fast bølgelængde eller kvantitative analyser målinger af sub-picomolar til mikromolære koncentrationer uden manuelt at ændre instrumentet.

figur 5. Kalibreringskurve for fluoresceinopløsninger fra 5 * 10-13 til 1,5 * 10-6 M ved hjælp af auto-SCS-funktionen.
anvendelser af Fluorescensspektroskopi
anisotropi
Fluorescensanisotropi observeres, når en fluorofor udsender lys med forskellige intensiteter afhængigt af polarisationsakserne og er beskrevet ved følgende ligning
r=Ivv-GIvh/Ivv+2givh
hvor er emissionsintensiteten parallel med polarisationsakserne og er eksitationsplan og er emissionsintensiteten vinkelret på eksitationsplanet. G kaldes G-Faktor eller instrumentgitterfaktor og tegner sig for polarisationsafhængigheden af emissionsmonokromatoren.
alle fluoroforer har overgangsmomenter, der forekommer langs specifikke retninger langs molekylaksen. Når de udsættes for polariseret lys, vil de tilfældigt orienterede fluoroforer, der har deres absorptionsovergangsmomenter orienteret omkring vinklen på det indfaldende lys, blive ophidset, og denne ophidsede tilstandspopulation er delvist orienteret. Når et molekyle vender tilbage fra en ophidset tilstand tilbage til sin jordtilstand, omfordeles elektronladningen, og ændringen i orienteringen af dipolmomenterne påvirker ophidselse og emissionspolariseringer. For eksempel, når fluorescens udsendes, før et molekyle roterer, vil fluorescenslyset blive stærkt polariseret mod retningen af eksitationslysets polarisering. Hvis lyset udsendes efter molekylets rotation i en helt tilfældig retning, vil fluorescensen ikke længere polariseres.
ved måling af fluorescensanisotropi vil følgende faktorer påvirke molekylær bevægelse: (1) molekylær størrelse, (2) viskositet af molekylets miljø og (3) Styrke og frihedsgrader for et bundet molekyle. Anisotropimålinger bestemmer den gennemsnitlige vinkelforskydning af en fluorofor, der opstår mellem absorption og emission af en foton. Vinkelforskydningen er afhængig af hastigheden og omfanget af rotationsdiffusionen i løbet af den ophidsede tilstands levetid. Når en fluorofor er ubegrænset og får lov til frit at rotere, før den genudsender en foton, er diffusionshastigheden generelt hurtigere end emissionshastigheden, og anisotropien er omtrent lig med nul. Rotationsdiffusion ændrer retningen af overgangsmomentet, som depolariserer emissionen. Jo mere begrænset fluoroforen er, desto større vil anisotropiværdien være, da faldet i fleksibilitet vil reducere den samlede rotationshastighed.
FRET
Fluorescensresonansenergioverførsel (FRET) er en mekanisme, der styrer energioverførslen mellem to nabomolekyler. En donor, oprindeligt i sin ophidsede tilstand, kan overføre energi til et acceptormolekyle gennem ikke-radiativ elektronresonans.
FRET overvåges af spektrofluorometeret, som måler fluorescens/slukning af acceptor eller ophidset donor. FRET effektivitet afhænger af følgende faktorer: afstanden mellem donor og acceptor, den spektrale overlapning mellem donor og acceptor og justeringen af deres dipolmomenter. Effektiviteten er omvendt proportional med den sjette effekt af afstanden mellem donor og acceptor, hvilket gør teknikken ekstremt følsom over for små ændringer i afstand. Når overlapningsområdet for donorfluorescensspektret og acceptorabsorptionsspektret er større, er FRET-effektiviteten højere. FRET-effektiviteten er også maksimalt, når de to dipolmomenter er parallelle eller antiparallelle med hinanden, og der sker ingen energioverførsel, når dipolmomenterne er vinkelret på hinanden. Typisk når afstanden mellem donor og acceptor er mellem 1 og 10 nm, opstår FRET.
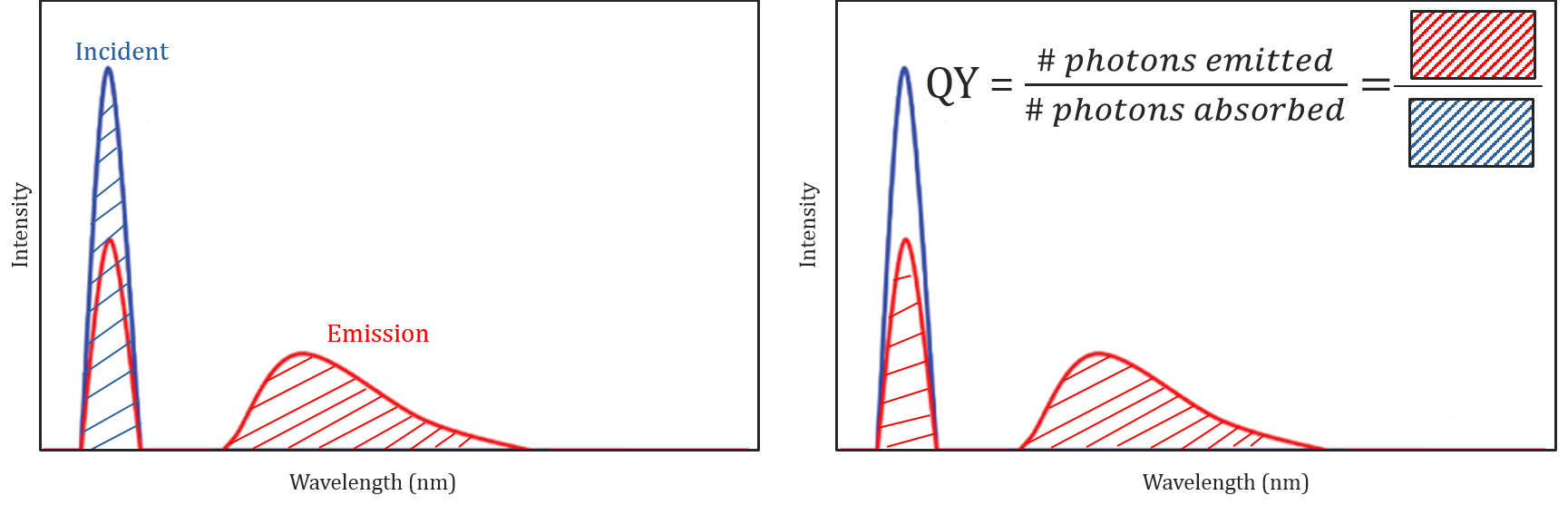
Kvanteudbytte og spektral korrektion
forskellige molekylære og miljømæssige forhold påvirker ikke kun, om et molekyle vil fluorescere eller ej, men kan også bestemme intensiteten eller kvanteudbyttet af den udsendte fluorescensstråling. Et molekyles effektivitet til fluorescering beskrives ved dets kvanteudbytte og defineres som forholdet mellem antallet af absorberede fotoner og antallet af fotoner, der udsendes af prøven.
i nogle tilfælde er det nødvendigt at bestemme nøjagtig spektral måling. Dette gøres ved hjælp af henvisninger til kendte kalibrerede materialer. De anvendte kalibrerede kilder kontrolleres for absolut spektral output på et kendt instrument, og der leveres et referencespektrum for at korrigere det enkelte instrument, der leveres til kunden. For at spektral korrektion skal fungere effektivt, skal den udføres ved hver instrumentparameter og båndbreddekombinationer, så den spektrale korrektion ved en 5 nm spektral båndbredde ikke kan anvendes til måling ved hjælp af en 10 nm SBV. Dette gælder for polarisatorernes position, hvis de anvendes, samt brugen af højere ordensfiltre. Det er nødvendigt at udføre den spektrale korrektion for hver kombination af spektrale båndbredder, der skal bruges af kunden, til inkludering eller udelukkelse af filtervalget med højere ordre og for polarisatorernes positioner, hvis de er monteret. Prøveekspression og emissionsbølgelængder bestemmer, hvilken løsning/lyskilde der bruges til kalibrering.
nær-infrarød
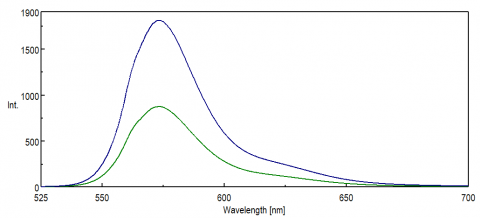
til applikationer, der undersøger Nir-regionen i spektret, er PMT-detektorens spektrale respons kritisk for at opnå data. I den røde ende af det synlige område, ind i NIR, falder kvanteeffektiviteten af PMT markant, hvilket resulterer i ringe eller ingen signalintensitet under prøvemålinger. FRET eksperimenter og Nir farvestoffer og prober overvåges ofte ved bølgelængder over 500 nm og har i mange tilfælde små signaler, selv for en så følsom teknik som fluorescens. Figur 8 illustrerer forskellen i fluorescensintensitet af rhodamin B ved hjælp af en standard PMT sammenlignet med en PMT, der er mere følsom over for bølgelængder i den røde ende af spektret.
Komplementær Teknik:
cirkulær Dikroismespektroskopi
cirkulær dikroismespektroskopi (CD) er en væsentlig analytisk teknik, der bruges til at analysere chiralitet i molekyler gennem deres optiske aktivitet. CD kan anvendes på en lang række molekylære strukturer, men har fundet fordel i det videnskabelige samfund til belysning af makromolekylær struktur, især proteiner og nukleinsyrer.