trifluorek bromu jest toksycznym związkiem międzyhalogenowym. Jest znany ze swoich zastosowań jako silny środek fluorujący.
Identyfikacja trifluorku bromu
Numer CAS: 7787-71-5
numer UN: UN1746
PubChem Compound ID: 24594
Numer referencyjny ChemSpider: 20474213
numer MDL: MFCD00042533
Numer WE: 232-132-1
numer RTECS: ED2275000
identyfikator InChI: InChI=1s/BrF3 / C2-1(3)4
InChI Key: InChIKey=FQFKTKUFHWNTBN-UHFFFAOYSA-N
Wzór chemiczny dla trifluorku bromu
wzór chemiczny tego związku międzyhalogenowego to BrF3.
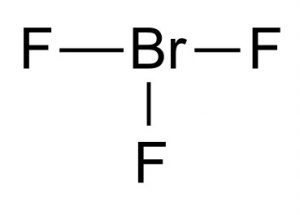
Zdjęcie 1-trifluorek bromu
produkcja trifluorku bromu
w roku 1906 Paul Lebeau zsyntetyzował ten związek po raz pierwszy przez reakcję bromu z fluorem w temperaturze 20°C. reakcja jest reprezentowana przez następujące równanie:
Br2 + 3F2 → 2brf3
innym sposobem wytwarzania trifluorku bromu jest jednoczesna redukcja i utlenianie monofluorku bromu. W wyniku tej reakcji powstaje trifluorek bromu i brom.
3brf → BrF3 + Br2
trifluorek bromu kompozycja
trifluorek bromu składa się z 58,367% bromu i 41,632% fluoru.
właściwości trifluorku bromu
fizyczne i chemiczne właściwości tej substancji są omówione poniżej:
wygląd
jest to ciecz w kolorze słomy.
zapach
substancja chemiczna ma ostry zapach.
Higroskopia
jest to ciecz higroskopijna.
Masa molowa
Masa molowa trifluorku bromu wynosi 136,90 g/mol.
Masa Monoizotopowa
masa monoizotopowa tej substancji wynosi 135,913547 u (unified atomic mass Unified).
gęstość
gęstość substancji wynosi 2,803 g / cm3.
Temperatura topnienia
temperatura topnienia trifluorku bromu wynosi 8,77°C.
Temperatura wrzenia
temperatura wrzenia tej substancji wynosi 125,72°C.
przewodność
dzięki autoionizacji ciecz jest dobrym przewodnikiem energii elektrycznej.
korozyjność
jest to żrąca ciecz.
ciężar właściwy
ciężar właściwy trifluorku bromu wynosi 2,81 w temperaturze 68,0°F.
moment dipolowy
molekularny moment dipolowy tej substancji wynosi 1,19 Debye.
Rozpuszczalność
trifluorek bromu jest rozpuszczalny w kwasie siarkowym. Rozkłada się i eksploduje w kontakcie ze związkami organicznymi i wodą. Reakcje ze związkami zawierającymi Wodór mogą powodować gwałtowne reakcje. Wiele fluorków jonowych łatwo rozpuszcza się w trifluorku bromu i tworzy solwobazy.
KF + BrF3 → Kbrf4
oprócz wyżej wymienionych właściwości, trifluorek bromu jest również silnym środkiem fluorującym.
struktura trifluorku bromu
struktura Lewisa trifluorku bromu pokazuje, że ma on strukturę molekularną w kształcie litery T. Zgodnie z teorią formowania molekularnego VSEPR centralny brom jest połączony z dwiema parami elektronów. Odległość między centrum bromu a fluorem równikowym wynosi 1,72 Å, a dla każdego z fluorów osiowych 1,81 Å. Kąt między fluorem równikowym a fluorem osiowym wynosi 86,2°. Kąt jest utrzymywany nieco poniżej 90° , ponieważ siła odpychania wiązań Br-F jest mniejsza niż siła par elektronów.
reakcje trifluorku bromu
trifluorek bromu w reakcji z tlenkami metali wydziela tlen. Gdy trifluorek bromu reaguje z dwutlenkiem krzemu, wytwarza gazowy tetrafluorek krzemu i brom.
w reakcji między trifluorkiem bromu i tlenkiem tytanu(IV) powstaje fluorek tytanu(IV) i brom.
Trifluorek bromu wykorzystuje
trifluorek bromu jest silnym jonizującym rozpuszczalnikiem nieorganicznym i środkiem fluorującym. Jest również stosowany do produkcji sześciofluorku uranu (UF6) podczas przetwarzania i ponownego przetwarzania paliwa jądrowego.
trifluorek bromu MSDS
zagrożenia dla zdrowia
człowiek narażony na trifluorek bromu może cierpieć z powodu następujących problemów zdrowotnych:
kontakt ze skórą: Kontakt skóry z tą substancją chemiczną może prowadzić do pieczenia i drażniących doznań.
kontakt wzrokowy: jeśli oczy wejdą w kontakt z oparami chemicznymi lub samą substancją chemiczną, może to prowadzić do silnego pieczenia oczu, wrzodów, a nawet ślepoty.
spożycie: spożycie prowadzi do silnego pieczenia błon śluzowych.
inhalacja: wdychanie może prowadzić do silnego podrażnienia górnych dróg oddechowych.
Środki pierwszej pomocy
oczy: oczy należy dokładnie umyć dużą ilością wody przez co najmniej 15 minut. Należy natychmiast skonsultować się z lekarzem.
Skóra: jeśli skóra wejdzie w kontakt z substancją chemiczną, zainfekowane obszary należy dobrze umyć wodą i mydłem przez co najmniej 15 minut. Wymagana jest natychmiastowa pomoc lekarska. Zanieczyszczoną odzież należy szybko usunąć. Ubrania powinny być dokładnie wyczyszczone i wysuszone przed ponownym użyciem. Zanieczyszczone buty powinny zostać zniszczone.
spożycie: w przypadku przypadkowego połknięcia ofiara powinna pić dużo wody. Nie zaleca się wywoływania wymiotów.
: W przypadku wystąpienia jakichkolwiek niekorzystnych skutków ofiara powinna zostać zabrana na nieskażony obszar. W przypadku, gdy ofiara nie oddycha, należy zastosować sztuczne oddychanie. Jeśli oddychanie i oddychanie jest nadal trudne, należy podać tlen. W celu zapewnienia bezpieczeństwa poszkodowanemu potrzebna jest dalsza pomoc medyczna.
profil reaktywności
trifluorek bromu jest wysoce reaktywnym środkiem utleniającym. Reaguje gwałtownie w kontakcie z wodą. Może przyspieszyć spalanie substancji palnej. W kontakcie z substancjami zawierającymi Wodór, takimi jak kwas octowy, amoniak i metan, może spowodować wybuch i pożar. Reaguje również gwałtownie z kwasami, halogenami, halogenkami metali, metalami i tlenkami metali w temperaturze pokojowej. Szczególnie powoduje niebezpieczne reakcje z kwasem azotowym, kwasem siarkowym, jodem i selenem.
środki przeciwpożarowe
trifluorek bromu jest środkiem utleniającym, dzięki czemu może się zapalić lub eksplodować w kontakcie z materiałami palnymi.
w przypadku dużych pożarów teren powinien być odizolowany i zalany wodą z bezpiecznej odległości. Jeśli pojemniki do przechowywania trifluorku bromu znajdują się w pobliżu ognia, należy je usunąć, jeśli można to zrobić bezpiecznie. Pojemniki należy schłodzić płynącą wodą nawet długo po ugaszeniu pożaru.
środki gaśnicze: podczas gaszenia pożaru należy użyć odpowiednich środków gaśniczych. Do gaszenia pożaru zaleca się stosowanie wody, suchej substancji chemicznej lub sody kalcynowanej.
środki przypadkowego uwolnienia
materiały palne powinny być izolowane i należy unikać jakiegokolwiek połączenia z nimi. Rozlanego materiału nie należy dotykać. Wycieki chemiczne należy zatrzymać, jeśli jest to możliwe bez ryzyka osobistego. Występowanie oparów chemicznych powinno być zmniejszone za pomocą rozpylania wody. Należy zachować ostrożność, aby nie dostać się wody do pojemników chemicznych. W przypadku dużych wycieków chemikalia powinny zostać poddane kwarantannie w celu późniejszego usunięcia. Obszar powinien być odpowiednio wentylowany.
Obsługa trifluorku bromu
obsługa tego materiału podlega przepisom dotyczącym obsługi zgodnie z us OSHA 29 CFR 1910.119.
Przechowywanie trifluorku bromu
substancja chemiczna powinna być przechowywana i przetwarzana zgodnie z obowiązującymi normami i przepisami kodeksu NFPA 430 do przechowywania ciekłych i stałych materiałów utleniających. Pojemniki chemiczne powinny być chronione przed wszelkiego rodzaju uszkodzeniami fizycznymi. Należy je również trzymać z dala od wszelkich niekompatybilnych substancji.
ochrona osobista
podczas obchodzenia się z tą substancją chemiczną należy podjąć odpowiednią ochronę. Należy użyć odpowiedniego sprzętu ochronnego. Powinny one idealnie obejmować:
- MSHA / NOSH (zatwierdzony lub równoważny) samodzielny aparat oddechowy posiadający ciśnieniowe maski tlenowe jest wymagany do prawidłowego oddychania.
- do ochrony oczu wymagane są okulary ochronne lub gogle ochronne zatwierdzone przez OSHA.
- w celu ochrony skóry przed szkodliwymi zakażeniami spowodowanymi kontaktem z substancjami chemicznymi należy stosować odzież ochronną i rękawice ochronne.
oprócz wyżej wymienionego sprzętu ochronnego, obszar powinien być również dobrze wentylowany. Mechanizm wentylacyjny powinien być odporny na wybuchy w przypadku wystąpienia wybuchowych stężeń substancji chemicznych. Należy również zapewnić lokalny układ wydechowy.