El óxido de berilio, también conocido por su nombre químico Berilia y el nombre IUPAC Oxoberilio, es un compuesto inorgánico inodoro representado por la fórmula BeO . Se presenta naturalmente como un bromelito mineral blanquecino raro . Al ser uno de los óxidos químicamente más estables, BeO puede resistir el ataque de metales líquidos y la reducción de carbono a altas temperaturas .
Beryllium Oxide Identification |
|
| CAS Number | 1304-56-9 |
| PubChem CID | 14775 |
| ChemSpider ID | 14092 |
| ChEBI | CHEBI:62842 |
| Número CE | 215-133-1 |
| Número RTECS | DS4025000 |
| Número ONU | 1566 |
| InChI Tecla | LTPBRCUWZOMYOC-UHFFFAOYSA-N |

Óxido de Berilio Fórmula
¿Cómo es el Óxido de Berilio Preparado
óxido de Berilio puede ser hecho por calcinación (calentamiento a altas temperaturas en presencia de oxígeno o de aire) berilio carbonato de :
BeCO3 → BeO + CO2
El hidróxido de berilio deshidratado a 400 °C también produce óxido de berilio en polvo blanco:
Be (OH) → BeO + HO
El metal de berilio en polvo se quema en el aire para hacer una mezcla de óxido de berilio y nitruro de berilio :
- 2Be + O2 → 2BeO
- 3Be + N2 → Be3N2

Polvo de Óxido de Berilio
Propiedades y características del Óxido de Berilio
Propiedades Generales |
|
| Masa molar / Peso molecular | 25.011 g/mol |
Propiedades Físicas |
|
| el Color y la Apariencia | polvo cristalino Blanco |
| Punto de Fusión | 2507 °C, 4545 °F |
| Punto de Ebullición | 3900 °C, 7052 °F |
| Densidad | 2.9 g cm-3 |
| Estado de la materia a temperatura ambiente (sólido/líquido/gas) | Sólido |
| Solubilidad | Soluble lentamente en hidróxidos alcalinos y ácidos concentrados |
| Solubilidad en Agua | Insoluble (0,00002 g / 100 mL) |
| Conductividad térmica (a temperatura ambiente) | 264 W / K. m |
| Capacidad calorífica | 1050 J / kg.K |
Propiedades Químicas |
|
| Ácido o base | Compuesto anfótero (reacciona como ácido y como base) |
Propiedades Atómicas |
|
| Estructura cristalina | Wurtzita hexagonal |
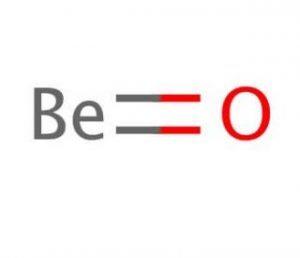
Estructura de óxido de berilio
Para qué se utiliza
- Para fabricar cerámicas de alta tecnología, aisladores eléctricos, disipadores de calor electrónicos, giroscopios, crisoles de boquillas de cohetes y vehículos blindados militares debido a su alta estabilidad .
- Construir radomos, antenas y ventanas en dispositivos de microondas, ya que es transparente a las microondas .
- Producción de sistemas de encendido automotriz, circuitos eléctricos de alta densidad, sistema de contramedidas electrónicas por radar, tubo de termopar y componentes estructurales láser .
El óxido de berilio es peligroso para la salud e Intoxicaciones
El óxido de berilio, en su forma en polvo, tiene propiedades cancerígenas y debe manipularse con extrema precaución . Puede causar intoxicación grave si se ingiere e inhala . Respirar vapores de óxido de berilio puede irritar los pulmones, la nariz y la garganta . La exposición elevada a BeO puede causar tos, dificultad para respirar, neumonía con fiebre, bronquitis y cáncer . El contacto con el polvo de óxido de berilio puede causar irritación de la piel e inflamación de los ojos . Los síntomas de la enfermedad del berilio incluyen fatiga, anorexia y una pérdida de peso dramática .
- Óxido De Berilio (Compuesto). – Pubchem.ncbi.nlm.nih.gov
- Óxido De Berilio – Chemspider.com
- Óxido De Berilio – Americanberyllia.com
- Óxido De Berilio – Americanelements.com
- CHEBI:62842 – óxido de berilio – Ebi.ac.uk
- Carbonato de berilio – Americanelements.com
- Hidróxido de berilio – Revolvy.com
- Berilio: reacción de elementos – Webelements.com
- Comportamiento anfótero – Chem.libretexts.org
- Hoja Informativa sobre Sustancias Peligrosas – Óxido de Berilio – Nj.gov