El elemento químico nihonium es clasificado como un otro metal. Fue descubierto en 2012 por el equipo de colaboración RIKEN de Kosuke Morita.

Zona de Datos
| Clasificación: | Nihonium es un ‘metal’ (que se supone) |
| peso Atómico: | (286), no isótopos estables |
| Estado: | sólido (se presume) |
| punto de Fusión: | |
| punto de Ebullición: | |
| los Electrones: | 113 |
| los Protones: | 113 |
| Neutrones en el isótopo más abundante: | 173 |
| capas de Electrones: | 2, 8, 18, 32, 32, 18, 3 |
| configuración Electrónica: | 5f14 6d10 7s2 7p1 |
Mostrar más, incluyendo: Calienta, las Energías, la Oxidación,
Reacciones, Compuestos, Radios, Conductividades
| la capacidad de calor Específico | – |
| el Calor de fusión | – |
| el Calor de atomización | – |
| Calor de vaporización | – |
| 1ª energía de ionización | – |
| 2 ª energía de ionización | – |
| 3 ª energía de ionización | – |
| afinidad Electrónica | – |
| Minimum oxidation number | – |
| Min. common oxidation no. | – |
| Maximum oxidation number | – |
| Max. common oxidation no. | – |
| Electronegatividad (Pauling Escala) | – |
| Polarizabilidad de volumen | – |
| la Reacción con el aire | – |
| la Reacción con 15 M de HNO3 | – |
| la Reacción con HCl 6 M | – |
| la Reacción con 6 M de NaOH | – |
| Óxido(s) | – |
| Hidruro(s) | – |
| Cloruro(s) | – |
| Atomic radius | – |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | – |
| Electrical conductivity | – |
| Congelación/Fusión punto de: | – |

Nihonium se produjo en un acelerador de partículas. Imagen: LLNL.
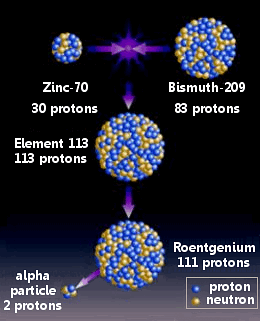
El nihonio se hizo combinando zinc-70 con bismuto-209 en una reación nuclear.
Descubrimiento de Nihonio
El nihonio fue descubierto el 12 de agosto de 2012 por el equipo de colaboración RIKEN de Kosuke Morita en Japón. Fue el primer elemento químico descubierto en Asia.
El descubrimiento fue aceptado formalmente el 30 de diciembre de 2015 por la IUPAC y la IUPAP, y un nuevo elemento superpesado tomó su lugar en la séptima fila de la tabla periódica.
El elemento lleva el nombre del lugar donde se sintetizó por primera vez; Nihon es una de las dos formas de decir Japón en japonés.
El nihonio se fabricó utilizando la Instalación de Acelerador Lineal de RIKEN y el separador de iones GARIS en Wako, Japón. El isótopo producido fue nihonio-278, que no permanece por mucho tiempo: su vida media es inferior a una milésima de segundo.
El equipo de Morita había comenzado su trabajo en septiembre de 2003. Los iones de zinc (70Zn) se formaron en un haz en un acelerador de partículas y se dispararon a una capa delgada de bismuto (209Bi) en una reacción de fusión en frío.
Usando este método, los científicos creyeron que hicieron un solo átomo del elemento 113 en julio de 2004 y nuevamente en abril de 2005. En cada ocasión, el átomo sufrió rápidamente cuatro desintegraciones alfa: primero a roentgenio-274, seguido de meitnerio-270, bohrio-266 y dubnio-262.
Descomposición alfa :
278Nh ==> 274Rg ==> 270Mt ==> 266Bh ==> 262Db
Estos resultados no fueron suficientes para satisfacer la IUPAC y la iupap. En 2011, su Grupo de Trabajo Conjunto se negó a aceptar el descubrimiento del elemento 113, afirmando que: «El trabajo de la colaboración de Morita et al. es muy prometedor, pero no ha cumplido los criterios de descubrimiento debido a la escasez de eventos, la ausencia de conexiones firmes con nucleidos conocidos y las inconsistencias señaladas anteriormente.»
Los científicos de Japón llegaron a un callejón sin salida. Morita, comentó: «Durante más de siete años, continuamos buscando datos que identificaran de manera concluyente el elemento 113, pero nunca vimos otro evento. Sin embargo, no estaba preparado para rendirme, ya que creía que un día, si perseverábamos, la suerte volvería a caer sobre nosotros.»
Para ayudar a validar su descubrimiento de nihonio, el equipo llevó a cabo un nuevo experimento que les daría una mejor idea de la cadena de desintegración más allá de 266Bh. Un haz de iones de sodio colisionó con un objetivo de curio creando 266Bh que luego decayó a 262Db.
El 12 de agosto de 2012, los científicos observaron un tercer y concluyente evento de desintegración. El nihonio se creó de la misma manera que antes y sufrió las mismas cuatro desintegraciones alfa que antes. Además, 262Db continuó experimentando decaimientos alfa, produciendo 258Lr seguido de 254Md. Como la cadena había sido completamente caracterizada, esto se tomó como una clara demostración de que la fuente de la cadena de desintegración era de hecho Nihonio, elemento 113.
En 2015, el Grupo de Trabajo Conjunto IUPAC / IUPAP examinó el trabajo y declaró que:: «El equipo de colaboración de RIKEN en Japón ha cumplido con los criterios para el elemento Z=113 y será invitado a proponer un nombre y un símbolo permanentes.»
Aspecto y características
Efectos nocivos:
El nihonio es nocivo debido a su radiactividad.
Características:
El nihonio es un metal radiactivo sintético.
Usos del nihonio
El nihonio es solo de interés para la investigación.
Abundancia e isótopos
Abundancia corteza terrestre: cero
Abundancia sistema solar: partes por billón en peso, partes por billón en moles
Costo, puro: $ por 100 g
Costo, a granel: $ por 100 g
Fuente: El elemento se ha creado utilizando una reacción de fusión en frío entre un objetivo de bismuto-209 y iones de zinc-70.
Isótopos: El nihonio tiene un isótopo cuya vida media se conoce, 278Nh.

- Experimento sobre la Síntesis del Elemento 113 en la Reacción, Revista de la Sociedad Física de Japón, Vol. 73, No. 10, octubre de 2004, pp. 2593-2596
- Observation of Second Decay Chain from 278113, Journal of the Physical Society of Japan Vol. 76, No. 4, Abril de 2007
- Robert Barber, Paul Karol, Hiromichi Nakahara, Emanuele Vardaci, y Erich Vogt, Descubrimiento de los elementos con números atómicos mayores o iguales a 113,. 2011, IUPAC. (descarga en pdf)
Cite esta página
Para enlaces en línea, copie y pegue uno de los siguientes enlaces:
<a href="https://www.chemicool.com/elements/ununtrium.html">Nihonium</a>
o
<a href="https://www.chemicool.com/elements/ununtrium.html">Nihonium Element Facts</a>
Para citar esta página en un documento académico, utilice la siguiente cita compatible con MLA:
"Nihonium." Chemicool Periodic Table. Chemicool.com. 11 Jun. 2016. Web. <https://www.chemicool.com/elements/ununtrium.html>.