Introduction
Le 7 novembre 2014, la Direction Générale de la Santé au Portugal a été informée par un laboratoire hospitalier local de 18 patients atteints de la maladie du légionnaire, tous admis dans les 24 heures précédentes depuis Vila Franca de Xira, ville à la périphérie de la capitale Lisbonne. Il est rapidement devenu évident que le nombre de cas augmentait et des cas ont été identifiés dans tout le Portugal. Un groupe de travail multidisciplinaire a enquêté sur l’épidémie, les résultats de leur enquête préliminaire ont conduit à la fermeture des systèmes de refroidissement industriel par voie humide. Au cours de l’enquête sur l’épidémie, nous avons présenté un rapport qui a été publié sous forme de communication rapide, fournissant des données préliminaires de l’enquête épidémiologique, microbiologique et environnementale.1 Cet article présente les résultats définitifs de l’enquête sur l’épidémie.
La maladie du légionnaire, décrite pour la première fois lors de la conférence de la Légion américaine de Philadelphie en 19762, est une infection pulmonaire bactérienne avec des espèces de Légionelles. La plupart des cas attribués à la maladie de L. pneumophila sg 1.3 se développent de manière caractéristique 2 à 10 jours après l’inhalation de bactéries aérosolisées par des individus sensibles. Les facteurs de risque comprennent le tabagisme, les personnes âgées et celles atteintes d’une maladie cardiorespiratoire chronique.4 L’eau, en milieu aquatique naturel ou artificiel, est le réservoir des espèces de Légionelles.5
De 2008 à 2012, entre 88 et 140 cas ont été signalés chaque année au Portugal, dont la majorité étaient des cas sporadiques d’acquisition communautaire.6 De grandes épidémies communautaires peuvent entraîner une morbidité et une mortalité importantes en peu de temps5, la plus importante à ce jour ayant été signalée en 2001 à Murcie, en Espagne, avec 449 cas.7
Souvent identifiés comme la source de grandes épidémies communautaires, les systèmes de tour de refroidissement industrielle8 sont capables de diffuser des aérosols contaminés sur de grandes distances.9 Les facteurs météorologiques, les conditions d’exploitation industrielle et un entretien inadéquat sont des facteurs de risque d’éclosions de légionelles associées aux tours.8,10
Méthodesdéfinitions
Un cas confirmé de maladie du Légionnaire présentait une pneumonie radiologiquement confirmée avec apparition de symptômes entre le 12 octobre et le 2 décembre 2014, qui vivait ou travaillait à moins de 10 km de Vila Franca de Xira et avait une confirmation d’infection en laboratoire. Les critères de laboratoire pour un cas confirmé comprenaient l’isolement de Legionella spp. des sécrétions respiratoires, la détection de L. antigène pneumophila sg1 dans l’urine, une augmentation significative du niveau d’anticorps spécifique de L. pneumophila sg 1 dans des échantillons de sérum appariés. Nous avons défini un cas probable qui ne différait que par la détection en laboratoire de l’une ou l’autre des Légionelles spp. acide nucléique dans les sécrétions respiratoires ou un seul taux élevé d’anticorps spécifique de L. pneumophila sg 1.
Identification des cas et évaluation de l’exposition
Les cas ont été identifiés en examinant les notifications réglementaires de laboratoire et les notifications cliniques électroniques à partir du 1er octobre 2014. Le personnel des autorités sanitaires régionales a interrogé tous les cas confirmés et probables en appliquant un questionnaire standard sur la maladie du légionnaire portugais qui enregistrait des détails démographiques, épidémiologiques et cliniques. L’adresse résidentielle de chaque cas a été géocodée dans Google Earth.
Pour identifier les décès, nous avons régulièrement croisé la base de données sur les épidémies avec le système portugais d’information en temps réel pour la certification des décès (SICO), de novembre 2014 à mars 2015.
Identification des sources
Les sources possibles de contamination par la légionelle, y compris les industries dotées de systèmes de refroidissement par voie humide, les hôpitaux, les centres commerciaux et les installations de loisirs publiques, ont été identifiées et, par mesure de précaution, fermées jusqu’à l’enquête environnementale. Les rapports d’exploitation et d’entretien ont été vérifiés et des échantillons ont été prélevés pour dépister la présence de Legionella spp., les résultats ont conduit à l’identification de sources potentielles. Les emplacements des sources potentielles ont été cartographiés à l’aide d’un repérage visuel dans Google Earth.
Caractérisation microbiologique, phénotypique et génotypique
La détection de l’antigène sg 1 de L. pneumophila a été réalisée à l’aide de tests d’antigènes urinaires spécifiques dans des laboratoires hospitaliers. Les échantillons respiratoires et sanguins ont été traités au laboratoire de référence, l’Institut national de la Santé, le Dr Ricardo Jorge. Des échantillons environnementaux ont été obtenus lors d’inspections effectuées par l’Inspection Générale de l’Agriculture, de la Mer, de l’Environnement et de l’Aménagement du Territoire conformément à la réglementation portugaise, et traités par le laboratoire de référence de l’Institut National de la Santé, le Dr Ricardo Jorge.
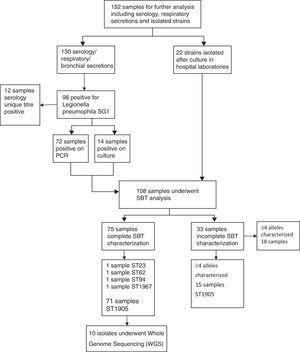
Des échantillons cliniques et environnementaux ont été analysés à l’aide de techniques de culture et/ ou moléculaires. Des échantillons cliniques ont été cultivés sur des milieux à base de BCYE et des échantillons environnementaux ont été cultivés dans des milieux sélectifs de GVPC. Des isolats ont été identifiés par des kits commerciaux d’agglutination au latex (Test de latex Legionella, Oxoid, Royaume-Uni et Microgen Legionella, Bioproduits Microgen®,). Les résultats de culture d’échantillons cliniques ont été vérifiés par PCR en temps réel ciblant les gènes 16S et/ou mip (L. pneumophila Real-TM, Sacace Biotechnologies, Italie; Argene Legio pneumo/Cc r-gene, bioMérieux, France). Les isolats, ou échantillons de culture négatifs / positifs à la PCR, ont été caractérisés par un typage basé sur les séquences (SBT) conformément aux directives du Groupe de travail Européen sur les infections à Légionelles (EWGLI).11 Les sept loci ont été soumis au séquençage de Sanger en utilisant la chimie BigDye v1.1 sur un analyseur génétique 3130XL (Applied Biosystems). Le séquençage du génome entier (WGS) a été réalisé pour 10 échantillons cliniques et un échantillon environnemental sur un instrument MiSeq (Illumina Inc., San Diego, États-Unis) en utilisant des cellules de flux MiSeq V2 et des lectures d’extrémité appariées 150bp (profondeur de couverture > 100 fois) pour déterminer leur similitude. Les lectures Illumina ont été assemblées en utilisant la caractérisation phénotypique de L de la version Velvet 1.2.10.12
. pneumophila sg1 a utilisé le panel d’anticorps monoclonaux de Dresde (mAbs) composé de six MAB plus le MAb 3 du Panel International obtenu à partir de l’American Type Culture Collection (ATCC). L’analyse a suivi un algorithme établi, approuvé par EWGLI, qui peut caractériser L. pneumophila dans l’un des neuf sous-groupes: Knoxville, Philadelphie, France / Allentown, Benidorm, OLDA, Oxford, Heysham, Camperdown et Bellingham.13 Le panel comprenait des anticorps dirigés contre le MAb 3/1 qui est considéré comme un marqueur de virulence en raison de l’hydrophobicité élevée de ces souches.
Aspects météorologiques et de la qualité de l’air
Les données ont été obtenues de la station météorologique de Vila Franca de Xira et de la station locale de qualité de l’air (Alverca). Des enregistrements deux fois par jour de la température et une fois par jour de l’humidité, de la qualité de l’air, de la vitesse et de la direction du vent ont été collectés pour la période du 18 octobre au 1er novembre 2014.
Analyse statistique
Nous avons effectué une analyse de proximité des sources de quatre sources potentielles pour tester l’hypothèse selon laquelle le risque de maladie était inversement lié à la distance de la source. À l’aide du logiciel QGIS, un tampon de 10 km de rayon subdivisé en anneaux concentriques de 1 km a été placé sur les tours de chaque système de refroidissement industriel. Le tampon et les anneaux ont ensuite été divisés en quatre quadrants, Nord-Est, Sud-Est, Sud-Ouest et Nord-Ouest. Nous avons comparé le nombre de cas avec les chiffres attendus. Pour calculer les cas prévus, les taux spécifiques à l’âge et au sexe pour l’éclosion ont été appliqués aux dénombrements de population de la sous-section du recensement de 2011. Les sous-sections ont été classées en fonction de la distance et de la direction de leur centroïde géographique par rapport à chaque source. Le nombre attendu de cas pour chaque quadrant de bande a été calculé comme la somme des cas attendus pour les sous-sections dont les centroïdes se trouvent à l’intérieur de celui-ci. En utilisant le test de Stones (ST), nous avons testé les ratios observés et attendus pour la diminution du risque, avec une distance allant jusqu’à 10 km dans le Nord-Est, le Nord-Ouest, le Sud-Est et le Sud-West14 avec 9999 simulations de Monte Carlo et avons fixé le seuil de signification statistique à 0,05,15
Modèles de calcul arrière développés par Egan et al.16 ont été utilisés pour estimer la période de libération d’aérosols au début de l’épidémie. Les modèles ont été répétés en utilisant des cas notifiés jusqu’en mars 2015. L’analyse statistique a été réalisée à l’aide du logiciel statistique R.
ResultsOutbreak description
Au 2 décembre 2014, 403 cas de maladie ont été identifiés dont 377 cas confirmés et 26 cas probables. Quatorze personnes sont décédées (taux de mortalité de 3,5 %).
Cas confirmés ont développé des symptômes entre le 14 octobre et le 2 décembre 2014. Le nombre de cas a atteint un sommet le 6 novembre et l’épidémie a été déclarée le 7 novembre (Fig. 1).

Cas confirmés de maladie du légionnaire par date d’apparition des symptômes, Vila Franca de Xira, Portugal, 14 octobre – 2 décembre 2014 (n = 377).
Les taux d’attaque les plus élevés ont été observés dans la paroisse de Póvoa de Santa Iria / Forte de Casa (60 pour 10 000 habitants) et ont diminué avec l’éloignement croissant de cette paroisse (Fig. 2).

Carte montrant le taux d’attaque de la maladie du légionnaire par lieu de résidence (paroisse), Vila Franca de Xira, Portugal.
Il y a eu 252 cas confirmés chez les hommes (66 %). L’âge médian était de 59 ans, le taux d’attaque était plus élevé chez les hommes et augmentait avec l’âge chez les deux sexes (25,1 pour 10 000 hommes âgés de 20 à 64 ans contre 37,9 pour 10 000 hommes âgés de plus de 65 ans) et les femmes (9,0 pour 10 000 femmes âgées de 20 à 64 ans contre 26,1 cas pour 10 000 femmes âgées de plus de 65 ans).
Deux cent huit (55 %) cas confirmés ont également signalé une sensibilité accrue à la maladie, le plus souvent due au tabagisme et aux maladies cardio-respiratoires chroniques.
Identification des sources
Quarante-neuf sources possibles; domestiques, publiques, commerciales et industrielles (5) ont été identifiées et réduites à quatre sources potentielles à la suite d’une enquête environnementale. Les quatre industries étaient équipées de systèmes de refroidissement par voie humide.
Trois des quatre sources potentielles ont signalé des cas suspects parmi les employés, neuf cas ont été confirmés.
Analyse microbiologique et phénotypique et caractérisation génétique
Le laboratoire de référence a reçu 95 échantillons environnementaux provenant de 49 sources possibles, dont des cultures positives de L. pneumophila ont été isolées dans 8. Ces échantillons provenaient de quatre industries dotées de systèmes de refroidissement par voie humide et d’un local commercial. Six des 8 cultures positives étaient des L. pneumophila sg 2-15 (75%). L. pneumophila sg 1 a été isolée à partir de deux échantillons environnementaux prélevés dans la même tour d’un système industriel, les concentrations enregistrées étaient de 1,42× 106ufc /l le 8 novembre et de 421ufc /l le 10 novembre. Le typage séquentiel de ces deux isolats environnementaux a permis d’identifier le nouveau génotype ST1905.
La confirmation des cas en laboratoire a été effectuée par; test d’antigène urinaire pour L. pneumophila sg 1 (92%); séroconversion (2%); PCR (3%) et titre unique de L. pneumophila (3%). 152 échantillons cliniques ont été envoyés au laboratoire de référence. Parmi ceux-ci, 71 ont révélé la présence de L. pneumophila sg 1 avec un profil SBT ST1905 identique.
37 isolats de L. pneumophila sg 1 ont subi une caractérisation phénotypique, 35 isolats provenant d’échantillons cliniques et deux d’échantillons environnementaux. Les 37 isolats présentaient tous la même caractéristique phénotypique ; sous-type France/Allentown et possédaient l’épitope associé à la virulence reconnu par l’anticorps monoclonal MAb 3/1 (Fig. 3).
Traitement microbiologique et résultats d’échantillons cliniques.
Pour confirmer la parenté génétique des isolats ST1905, 10 des 71 isolats cliniques et un isolat environnemental positif obtenus à partir de la tour de refroidissement industrielle ont été nominalement sélectionnés pour le séquençage du génome entier. Nous avons pu en utiliser environ 99.8% de chaque séquence de brouillon et n’ont trouvé aucune différence nucléotidique dans les 3,47 Mo du génome comparés. L’analyse phylogénétique impliquant plusieurs isolats de L. pneumophila provenant de partout dans le monde a révélé que le groupe ST1905 divergeait clairement de la branche regroupant les souches de L. pneumophila les plus étudiées (sérogroupes 1, 6 et 12) 17-19 et était plus étroitement apparenté à L. pneumophila subsp. souches de fraseri (sérogroupes 4, 5 et 15).La confirmation par 20 WGS du profil allélique ST1905 a mis en évidence un biais associé à l’extraction in silico de la séquence allélique pour le locus mompS. La souche étudiée présentait des copies de mompS non correspondantes, ce qui entravait une attribution ST correcte si le SBT était exclusivement déterminé in silico (Fig. 4).
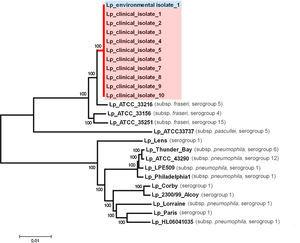
Arbre phylogénétique comparant la séquence entière du génome des isolats environnementaux et cliniques.
Résultats météorologiques, climatiques et de la qualité de l’air
Des températures supérieures à la moyenne mensuelle ont été enregistrées du 18 octobre au 1er novembre (> 20 ° C), avec une inversion thermique nocturne persistante associée à un vent prédominant NE et NNE avec une vitesse de 2 à 3 km/h. La dernière semaine d’octobre avait plus de 80% d’humidité relative, avec des périodes dépassant 90%. Octobre 2014 a été le mois d’octobre le plus chaud au Portugal continental depuis 1931, y compris une vague de chaleur de 11 jours pendant la période du 17 au 27 octobre. Du 19 octobre au 1er novembre, trois fois le niveau recommandé de particules (PM10) et les valeurs hebdomadaires les plus élevées de 2014 ont été enregistrées à la station de qualité de l’air locale, attribuée à un fort épisode de poussière du Sahara transportée vers le Portugal continental.
Période d’évaluation de l’exposition
Les modèles de rétro-calcul les mieux adaptés suggèrent une croissance logistique de l’exposition environnementale, avec la plus grande intensité entre le 16 octobre et le 4 novembre (Fig. 1).
Résultats de l’analyse de proximité de la source
Lorsque l’analyse de proximité de la source a été effectuée, il y avait 365 cas confirmés, dont 328 (90 %) étaient géoréférencés à moins de 10 km de l’une des quatre sources potentielles (Fig. 5).
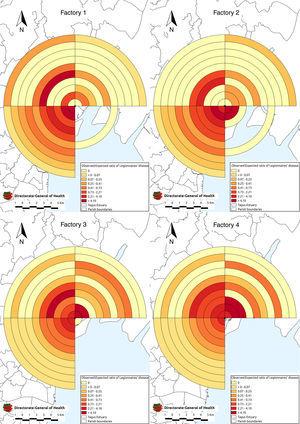
Maladie du légionnaire près de quatre industries dotées de systèmes de refroidissement par voie humide par distance de résidence de la ou des tours.
Les quatre sources potentielles ont démontré une baisse significative du risque de maladie avec l’augmentation de la distance (regroupement) dans le quadrant sud-ouest. Le groupement le plus élevé (ST157, p
0,001) a été observé dans le quadrant SW de l’industrie 1. Des regroupements ont également été observés avec l’industrie 2 (ST 117, p0.001), l’industrie 3 (ST 126, p0.001) et l’industrie 4 (ST 66.1, p0.001). Le risque de maladie a diminué de façon constante avec l’augmentation de la distance par rapport à la source, sans qu’il y ait de pics ou de creux dans ce quadrant. Aucun regroupement n’a été observé dans les quadrants SE d’une industrie, une zone qui comprenait en grande partie la rivière. Les industries 1 et 2 ont montré un degré de regroupement plus faible dans le quadrant NE (ST 5, p = 0,01 et ST 4,2, p = 0,01 respectivement). Le regroupement a également été démontré dans le quadrant NORD-ouest de l’industrie 1 (ST 3,9, p = 0,01).Discussion
Nous avons identifié quatre industries dotées d’un système de refroidissement par voie humide comme étant les sources les plus probables de la deuxième plus grande épidémie de légionnaire enregistrée avec 403 cas et 14 décès. Concentrations élevées de L. des pneumophila sg 1 ST1905 démontrant le sous-groupe virulent MAb 3-1 ont été identifiés dans les tours d’une industrie. En utilisant SBT et WGS, nous avons pu confirmer la parenté génétique des souches cliniques et environnementales associées à l’éclosion. Les seuls isolats positifs pour L. pneumophila sg 1 ont tous deux été obtenus à partir de la tour de refroidissement d’une industrie. Des concentrations similaires de L. pneumophila ont été isolées dans d’autres tours de refroidissement associées à des éclosions.5 Il est probable, bien que non prouvé, que la contamination croisée des quatre tours situées à proximité ait contribué à l’ampleur de l’épidémie et a déjà été décrite.21
Les températures anormalement chaudes enregistrées en octobre 2014 ont soutenu la prolifération d’espèces de Légionelles dans les systèmes de tours de refroidissement.22 Les concentrations élevées de PM10 pourraient avoir agi comme des noyaux de concentration de nuages facilitant la formation d’aérosols. La distribution et le grand nombre de cas sont expliqués par le vent de NE, l’humidité relative élevée et l’inversion thermique observés pendant la période de libération estimée en plus de la longévité 23 et de la virulence accrue 24 d’une bactérie avec épitope MAb3/1.
L’épidémie s’est produite dans une zone densément peuplée proche de la capitale du Portugal, où se trouvaient des routes de banlieue très fréquentées depuis les zones suburbaines. Le nombre réel de personnes exposées était probablement beaucoup plus élevé que la population résidente. Les tests de diagnostic standard peuvent ne pas détecter tous les cas.3 Les chiffres présentés ne contiennent pas de cas de fièvre de Pontiac ou de cas suspects dont le test était négatif et sous-estiment donc probablement la morbidité ressentie par la communauté et l’impact sur les services de santé locaux. En revanche, en raison de la présence d’un avis de décès électronique au Portugal, il était possible de s’assurer que les informations sur le décès d’un cas étaient complètes. Le taux de mortalité observé (3,5 % de tous les cas) était inférieur aux 6 % habituellement observés dans les éclosions associées aux tours et aux systèmes de refroidissement.8 La souche responsable de l’éclosion s’est regroupée phylogénétiquement en dehors des souches de L. pneumophila sg 1 associées à l’éclosion les plus étudiées (Lp Philadelphia-1, Lp Paris, Lp Lens, Lp Corby et Lp 2300/99 Alcoy). Il s’est avéré être étroitement apparenté à L. pneumophila subsp. souches de fraseri provenant de sérogroupes autres que sg 1. La souche étudiée abrite une région génomique exclusive de ∼38 ko par rapport à la souche suivante la plus apparentée phylogénétiquement. Cette région n’a été trouvée intacte et très similaire (BLASTn, couverture 100%, identité 99%, valeur E 0,0) que dans une seule souche (ATCC 33761 = DSM 21215) de L. oakridgensis, une espèce qui cause rarement la maladie du légionnaire.25 Nous expliquerions le faible taux de mortalité observé en termes de diagnostic précoce et de traitement approprié et rapide, si les traits uniques de la souche associée à l’éclosion sous-tendent des caractéristiques importantes de létalité restent à l’étude.
L’analyse de la proximité des sources a estimé le nombre prévu de cas dans la population résidente, ce qui a probablement conduit à une sous-estimation de l’exposition. Nous avons estimé que les informations résidentielles étaient collectées systématiquement, contrairement à l’historique des déplacements, les conditions de propagation horizontale des aérosols étaient également plus prononcées la nuit, alors que la plupart des résidents auraient été chez eux. Une approche plus robuste devrait effectuer l’analyse dans le cadre d’une étude cas-témoins, qui pourrait également inclure des expositions chez des non-résidents. Bien que nous en ayons discuté au départ, nous n’avons pas procédé à une étude cas–témoins en raison de contraintes de ressources et de temps. La proximité géographique des tours signifiait qu’il y avait un chevauchement de certaines des zones d’étude, ce qui rendait possible, mais il est peu probable qu’une source située à proximité puisse entraîner la présence d’une relation de déclin de distance pour une autre source. La comparaison de la distribution géospatiale des cas avec la modélisation des panaches d’aérosols pourrait être utile pour évaluer l’impact de sources proches les unes des autres.
Cette éclosion était la deuxième plus grande éclosion de maladie du légionnaire enregistrée à ce jour et vient s’ajouter à l’ensemble des preuves concernant l’impact des conditions climatiques et des phénotypes bactériens dans les éclosions communautaires de la maladie du légionnaire associées aux tours de refroidissement.
Conflits d’intérêts
Les auteurs n’ont aucun conflit d’intérêts à déclarer.