Généralement, les amides peuvent être hydrolysés en solution acide ou basique. Les mécanismes ressemblent beaucoup à ceux de l’hydrolyse des ester (section 18-7A), mais les réactions sont beaucoup plus lentes, une propriété d’une grande importance biologique (dont nous parlerons plus loin):
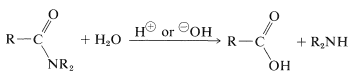
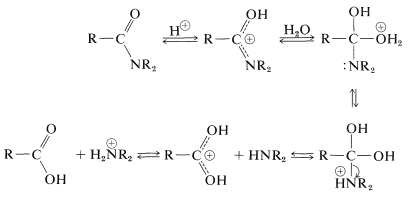
Comme nous l’avons indiqué dans la section 23-12, l’hydrolyse des amides peut être une voie importante vers les amines. L’hydrolyse dans des conditions acides nécessite des acides forts tels que sulfurique ou chlorhydrique, et des températures d’environ \(100^\text{o}\) pendant plusieurs heures. Le mécanisme implique une protonation de l’amide sur l’oxygène suivie d’une attaque de l’eau sur le carbone carbonyle. L’intermédiaire tétraédrique formé se dissocie finalement de l’acide carboxylique et du sel d’ammonium:
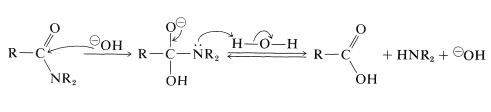
En hydrolyse alcaline, l’amide est chauffé avec de l’hydroxyde de sodium ou de potassium aqueux bouillant. L’ion hydroxyde nucléophile s’ajoute au carbone carbonyle pour former un intermédiaire tétraédrique qui, à l’aide du solvant aqueux, expulse l’azote sous forme d’amine libre:
L’hydrolyse biologique des amides, comme dans l’hydrolyse des peptides et des protéines, est catalysée par les enzymes protéolytiques. Ces réactions seront discutées au chapitre 25.
Une méthode indirecte d’hydrolyse de certains amides utilise l’acide nitreux. Les amides primaires sont facilement convertis en acides carboxyliques par traitement à l’acide nitreux. Ces réactions sont très similaires à celles qui se produisent entre une amine primaire et l’acide nitreux (section 23-10):
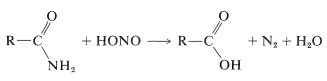
Les amides secondaires donnent des composés \(\ce{N}\)-nitroso avec l’acide nitreux, alors que les amides tertiaires ne réagissent pas:
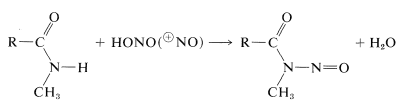
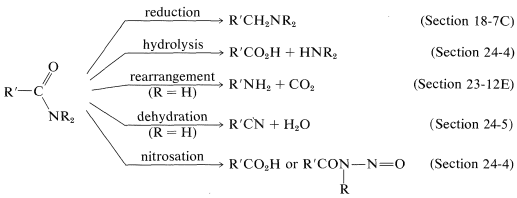
Voici un bref résumé des réactions amides importantes:
Parmi les nombreux autres types de composés organonitrogènes connus, les plus importants comprennent

Bien qu’il ne soit pas pratique de discuter de tous ces composés en détail, nous allons maintenant en discuter brièvement plusieurs qui n’ont pas reçu beaucoup d’attention jusqu’à présent.
Contributeurs et attributions
- John D. Robert et Marjorie C. Caserio (1977) Principes de base de la chimie organique, deuxième édition. W.A. Benjamin, Inc. , Parc de Menlo, CA. ISBN 0-8053-8329-8. Ce contenu est protégé par le droit d’auteur dans les conditions suivantes: « Vous êtes autorisé à reproduire, distribuer, afficher et exécuter cette œuvre de manière individuelle, éducative, à des fins de recherche et à des fins non commerciales dans n’importe quel format. »