Generalmente, las amidas se pueden hidrolizar en solución ácida o básica. Los mecanismos son muy parecidos a los de la hidrólisis de ésteres (Sección 18-7A), pero las reacciones son mucho más lentas, una propiedad de gran importancia biológica (de la que hablaremos más adelante):
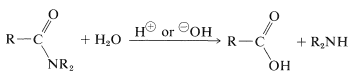
Como hemos indicado en la Sección 23-12, la hidrólisis de amidas puede ser una ruta importante para las aminas. La hidrólisis en condiciones ácidas requiere ácidos fuertes, como sulfúrico o clorhídrico, y temperaturas de aproximadamente \(100^\text{o}\) durante varias horas. El mecanismo implica la protonación de la amida en el oxígeno, seguida de un ataque de agua sobre el carbono carbonílico. El intermedio tetraédrico formado se disocia en última instancia con el ácido carboxílico y la sal de amonio:
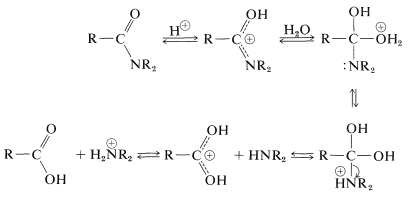
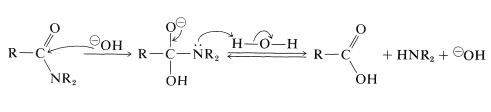
En hidrólisis alcalina, la amida se calienta con hidróxido de sodio o potasio acuoso hirviendo. El ion hidróxido nucleofílico se agrega al carbono carbonílico para formar un intermedio tetraédrico, que, con la ayuda del disolvente acuoso, expulsa el nitrógeno en forma de amina libre:
La hidrólisis biológica de amidas, como en la hidrólisis de péptidos y proteínas, es catalizada por las enzimas proteolíticas. Estas reacciones se analizarán en el capítulo 25.
Un método indirecto de hidrolización de algunas amidas utiliza ácido nitroso. Las amidas primarias se convierten fácilmente en ácidos carboxílicos mediante tratamiento con ácido nitroso. Estas reacciones son muy similares a las que se producen entre una amina primaria y el ácido nitroso (Sección 23-10):
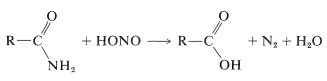
Las amidas secundarias dan \(\ce{N}\)-compuestos nitrosos con ácido nitroso, mientras que las amidas terciarias no reaccionan:
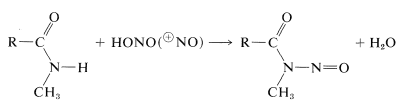
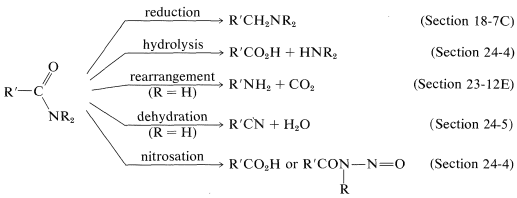
A continuación se presenta un breve resumen de las reacciones importantes a la amida:
De los muchos otros tipos de compuestos organonitrógenos conocidos, los más importantes incluyen

Aunque no es práctico discutir todos estos compuestos en detalle, ahora discutiremos brevemente varios a los que no se ha prestado mucha atención hasta ahora.
Colaboradores y atribuciones
- John D. Robert y Marjorie C. Caserio (1977) Principios Básicos de Química Orgánica, segunda edición. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Este contenido está protegido por derechos de autor bajo las siguientes condiciones: «Se le concede permiso para la reproducción, distribución, exhibición y ejecución individual, educativa, de investigación y no comercial de este trabajo en cualquier formato.»