En comparant les anhydrides d’acide avec les chlorures d’acyle (chlorures d’acide)
Vous avez presque certainement rencontré des anhydrides d’acide pour la première fois juste après avoir examiné les chlorures d’acyle, ou vous les étudiez peut-être en même temps que les chlorures d’acyle. Il est beaucoup, beaucoup plus facile de penser aux anhydrides d’acide comme s’ils étaient une sorte de chlorure d’acyle modifié que d’essayer de les connaître à partir de zéro. C’est la ligne que j’ai l’intention de suivre tout au long de cette section. Comparez la structure d’un anhydride d’acide avec celle d’un chlorure d’acyle – en regardant attentivement la couleur dans le diagramme.
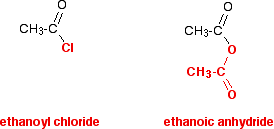
Dans les réactions de l’anhydride éthanoïque, le groupe rouge au fond reste toujours intact. Il se comporte de plusieurs façons comme s’il s’agissait d’un seul atome – tout comme l’atome de chlore dans le chlorure d’acyle. La réaction habituelle d’un chlorure d’acyle est le remplacement du chlore par autre chose.
En prenant le chlorure d’éthanoyle comme typique, la réaction initiale est de ce genre:

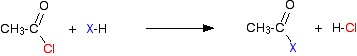
Le chlorure d’hydrogène gazeux est émis, bien que cela puisse continuer à réagir avec d’autres composants du mélange. Avec un anhydride d’acide, la réaction est plus lente, mais la seule différence essentielle est qu’au lieu de produire du chlorure d’hydrogène comme l’autre produit, vous obtenez à la place de l’acide éthanoïque.

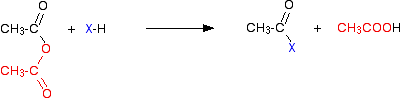
Tout comme le chlorure d’hydrogène, cela pourrait ensuite réagir avec d’autres choses présentes. Les réactions (des chlorures d’acyle et des anhydrides d’acide) impliquent des choses comme l’eau, les alcools et les phénols, ou l’ammoniac et les amines. Tous ces cas particuliers contiennent un élément très électronégatif avec une seule paire d’électrons actifs – soit l’oxygène, soit l’azote.