Generalmente, le ammidi possono essere idrolizzate in soluzione acida o basica. I meccanismi sono molto simili a quelli dell’idrolisi dell’estere (Sezione 18-7A), ma le reazioni sono molto più lente, una proprietà di grande importanza biologica (di cui parleremo più avanti):
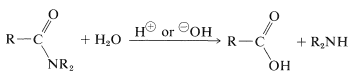
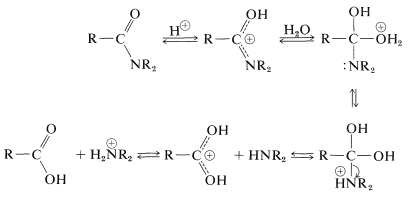
Come abbiamo indicato nella Sezione 23-12, l’idrolisi dell’ammide può essere una via importante per le ammine. L’idrolisi in condizioni acide richiede acidi forti come solforico o cloridrico e temperature di circa \(100 ^ \ text{o}\) per diverse ore. Il meccanismo comporta la protonazione dell’ammide sull’ossigeno seguita dall’attacco dell’acqua sul carbonio carbonilico. L’intermedio tetraedrico formato si dissocia in definitiva all’acido carbossilico e al sale di ammonio:
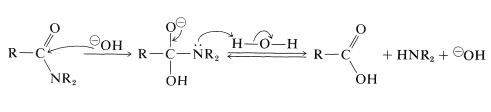
Nell’idrolisi alcalina l’ammide viene riscaldata con sodio acquoso bollente o idrossido di potassio. Lo hydroxide idrossido nucleofilo si aggiunge al carbonio carbonilico per formare un intermedio tetraedrico, che, con l’aiuto del solvente acquoso, espelle l’azoto come ammina libera:
L’idrolisi biologica dell’ammide, come nell’idrolisi dei peptidi e delle proteine, è catalizzata dagli enzimi proteolitici. Queste reazioni saranno discusse nel Capitolo 25.
Un metodo indiretto di idrolizzazione di alcune ammidi utilizza acido nitroso. Le ammidi primarie vengono convertite facilmente in acidi carbossilici mediante trattamento con acido nitroso. Queste reazioni sono molto simili a quella che si verifica tra un’ammina primaria e l’acido nitroso (Sezione 23-10):
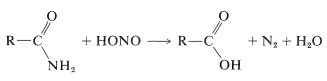
Le ammidi secondarie danno composti\(\ce{N}\)-nitroso con acido nitroso, mentre le ammidi terziarie non reagiscono:
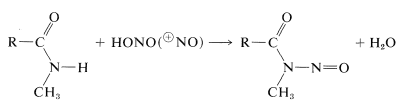
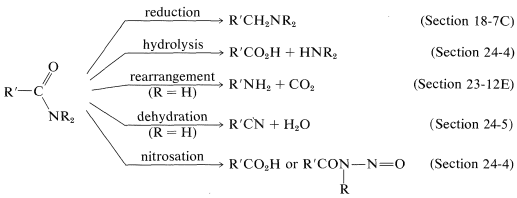
Segue un breve riassunto delle importanti reazioni ammidiche:
Tra i molti altri tipi di composti organonitrogeni noti, i più importanti includono

Anche se non è pratico per discutere tutti questi composti in dettaglio, ora discuteremo brevemente diversi che non hanno ricevuto molta attenzione finora.
Contributori e attribuzioni
- John D. Robert e Marjorie C. Caserio (1977) Principi di base della chimica organica, seconda edizione. Per maggiori informazioni:
, Menlo Park, CA. ISBN 0-8053-8329-8. Questo contenuto è protetto da copyright alle seguenti condizioni :” Ti viene concesso il permesso per la riproduzione individuale, educativa, di ricerca e non commerciale, la distribuzione, la visualizzazione e l’esecuzione di questo lavoro in qualsiasi formato.”