Confronto di anidridi acide con cloruri acilici (cloruri acidi)
Hai quasi certamente incontrato anidridi acide per la prima volta subito dopo aver esaminato i cloruri acilici, o potresti studiarli contemporaneamente ai cloruri acilici. È molto, molto più facile pensare alle anidridi acide come se fossero una sorta di cloruro di acile modificato piuttosto che cercare di impararle da zero. Questa è la linea che intendo seguire in tutta questa sezione. Confronta la struttura di un’anidride acida con quella di un cloruro di acile – osservando attentamente il modo in cui è il colore nel diagramma.
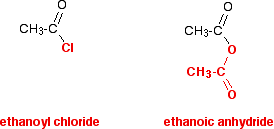
Nelle reazioni dell’anidride etanoica, il gruppo rosso nella parte inferiore rimane sempre intatto. Si comporta in molti modi come se fosse un singolo atomo-proprio come l’atomo di cloro nel cloruro di acile. La reazione usuale di un cloruro di acile è la sostituzione del cloro con qualcos’altro.
Prendendo il cloruro di etanoile come tipico, la reazione iniziale è di questo tipo:

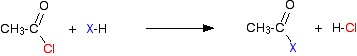
Il gas di cloruro di idrogeno viene emesso, anche se potrebbe continuare a reagire con altri componenti della miscela. Con un’anidride acida, la reazione è più lenta, ma l’unica differenza essenziale è che invece di produrre cloruro di idrogeno come l’altro prodotto, si ottiene invece acido etanoico.

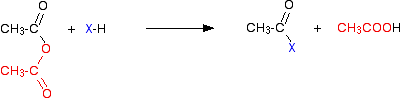
Proprio come il cloruro di idrogeno, questo potrebbe poi continuare a reagire con altre cose presenti. Le reazioni (sia dei cloruri acilici che delle anidridi acide) coinvolgono cose come acqua, alcoli e fenoli o ammoniaca e ammine. Tutti questi casi particolari contengono un elemento molto elettronegativo con una coppia solitaria attiva di elettroni-ossigeno o azoto.