산 무수물과 아실 클로라이드 비교(산 염화물)
아실 클로라이드를 살펴본 후 처음으로 산 무수물을 발견했거나 아실 클로라이드와 동시에 연구 중일 수 있습니다. 산 무수물을 마치 변성 아실 클로라이드라고 생각하는 것은 처음부터 그것에 대해 배우는 것보다 훨씬 쉽습니다. 이것이 제가 이 모든 부분에 걸쳐 다루고자 하는 부분입니다. 산 무수물의 구조를 아실 클로라이드의 구조와 비교하십시오-다이어그램에서 색상 인 방식을주의 깊게 살펴보십시오.
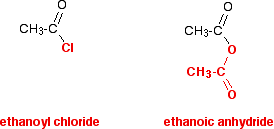
에탄산 무수물의 반응에서는,바닥에 빨간 그룹은 항상 본래대로 체재합니다. 아실 클로라이드의 염소 원자와 마찬가지로 단일 원자 인 것처럼 여러 가지 방식으로 행동하고 있습니다. 아실 클로라이드의 일반적인 반응은 염소를 다른 것으로 대체하는 것입니다.
에타노일 클로라이드를 전형적인 것으로 취함으로써,초기 반응은 이러한 종류의 것이다:

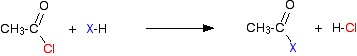
염화수소 가스는 혼합물의 다른 성분과 반응하기 위해 계속 될 수도 있지만 방출됩니다. 산성 무수물로,반응은 더 느립니다,그러나 유일한 근본적인 다름은 다른 제품으로 생성하는 수소 염화물 대신에,당신이 에탄 산을 대신 얻는다는 것을 입니다.

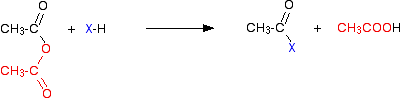
염화수소와 마찬가지로,이것은 나중에 존재하는 다른 것들과 반응 할 수 있습니다. 반응(아실 클로라이드와 산 무수물 모두)은 물,알코올 및 페놀,암모니아 및 아민과 같은 것들을 포함합니다. 이 모든 특별한 경우에는 산소 또는 질소와 같은 활성 고독한 전자 쌍을 가진 매우 전기 음성 요소를 포함합니다.