in het algemeen kunnen amiden gehydrolyseerd worden in zure of basische oplossing. De mechanismen lijken veel op die van esterhydrolyse (sectie 18-7A), maar de reacties zijn veel trager, een eigenschap van groot biologisch belang (die we later zullen bespreken):
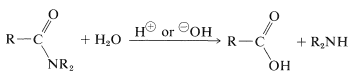
zoals we in sectie 23-12 hebben aangegeven, kan amidehydrolyse een belangrijke route naar aminen zijn. Hydrolyse onder zure omstandigheden vereist sterke zuren zoals zwavelzuur of zoutzuur, en temperaturen van ongeveer \(100^ \ text{o}\) gedurende enkele uren. Het mechanisme impliceert protonatie van het amide op zuurstof gevolgd door aanval van water op de carbonylkoolstof. Het gevormde tetraëdrische tussenproduct dissocieert uiteindelijk met het carbonzuur en het ammoniumzout:
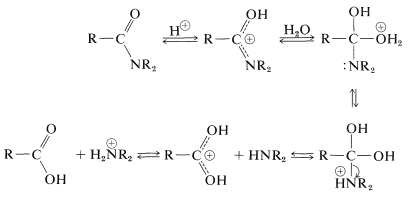
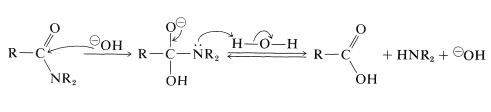
bij alkalische hydrolyse wordt het amide verwarmd met kokend waterig natrium-of kaliumhydroxide. Het nucleofiele hydroxideion voegt aan de carbonylkoolstof toe om een tetraëdrisch tussenproduct te vormen, dat, met behulp van het waterige oplosmiddel, de stikstof als vrije amine uitdrijft:
de biologische amidehydrolyse, zoals in de hydrolyse van peptiden en proteã nen, wordt gekatalyseerd door de proteolytische enzymen. Deze reacties zullen in hoofdstuk 25 worden besproken.
een indirecte hydrolyseringsmethode voor sommige amiden maakt gebruik van salpeterzuur. Primaire amiden worden gemakkelijk omgezet in carbonzuren door behandeling met salpeterzuur. Deze reacties zijn zeer vergelijkbaar met die welke optreedt tussen een primaire amine en salpeterigzuur (Paragraaf 23-10):
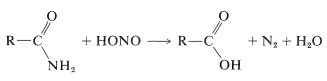
Secundaire amiden geven \(\ce{N}\)-nitroso verbindingen met salpeterigzuur, terwijl tertiaire amiden niet reageren:
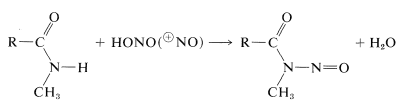
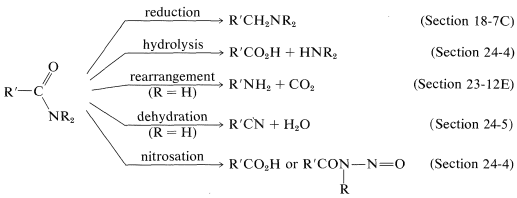
Een korte samenvatting van belangrijke amide reacties volgt:
van de vele andere soorten organonitrogen verbindingen bekend, de belangrijkste omvatten

hoewel het onpraktisch is om al deze samenstellingen in detail te bespreken, zullen wij nu kort verscheidene bespreken die tot dusver niet veel aandacht hebben gekregen.
bijdragers en toeschrijvingen
- John D. Robert en Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Deze inhoud is auteursrechtelijk beschermd onder de volgende voorwaarden: “u krijgt toestemming voor individuele, educatieve, onderzoek en niet-commerciële reproductie, distributie, weergave en uitvoering van dit werk in elk formaat.”