comparând anhydrides acide cu cloruri acil (cloruri acide)
ați venit aproape sigur peste anhydrides acide pentru prima dată doar după uita la cloruri acil, sau poate fi studiind-le în același timp cu cloruri acil. Este mult, mult mai ușor să te gândești la anhidridele acide ca și cum ar fi un fel de clorură de acil modificată decât să încerci să înveți despre ele de la zero. Aceasta este linia pe care intenționez să o urmez în toată această secțiune. Comparați structura unei anhidride acide cu cea a unei cloruri de acil – privind cu atenție modul în care este culoarea din diagramă.
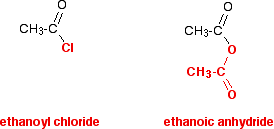
în reacțiile anhidridei etanoice, grupul roșu din partea de jos rămâne întotdeauna intact. Se comportă în multe feluri ca și cum ar fi un singur atom – la fel ca atomul de clor din clorura de acil. Reacția obișnuită a unei cloruri de acil este înlocuirea clorului cu altceva.
luând clorura de etanoil ca tipică, reacția inițială este de acest fel:

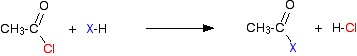
gazul de clorură de hidrogen este emis, deși ar putea continua să reacționeze cu alte componente ale amestecului. Cu o anhidridă acidă, reacția este mai lentă, dar singura diferență esențială este că, în loc să se producă clorură de hidrogen ca celălalt produs, veți obține în schimb acid etanoic.

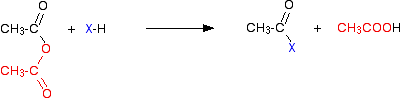
la fel ca și clorura de hidrogen, aceasta ar putea reacționa ulterior cu alte lucruri prezente. Reacțiile (atât ale clorurilor de acil, cât și ale anhidridelor acide) implică lucruri precum apa, alcoolii și fenolii sau amoniacul și aminele. Toate aceste cazuri particulare conțin un element foarte electronegativ cu o pereche activă de electroni – fie oxigen, fie azot.