Die van der Waals-Gleichung wurde im Jahr 1873 vorgeschlagen. Es war ein erster Schritt zur Berücksichtigung von Wechselwirkungskräften, die zwischen realen Gasmolekülen wirken.
Die Zustandsgleichung des perfekten Gases bezieht sich auf ein Gas, das aus punktartigen Elementen besteht, die nicht miteinander wechselwirken.
Stattdessen schlug van der Waals eine Gleichung vor
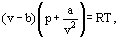
wobei a und b die sogenannten Van-der-Waals-Konstanten sind und für jedes Gas unterschiedliche Werte haben.
Die b-Korrektur berücksichtigt die Tatsache, dass nach van der Waals. die realen Gasmoleküle können sich nicht in dem Gesamtvolumen bewegen, das das Gas einnimmt, sondern nur in einem Teil dieses Volumens, der durch Subtraktion des so genannten eigenen Volumens der Moleküle definiert wird. Die Korrektur a/ ν2 – proportional zum Quadrat der Dichte – berücksichtigt die Anziehungskräfte zwischen Gasmolekülen. Nach der van-der-Waals-Annahme verringern diese Kräfte den Druck gegen die Gefäßwände, da die wandnahen Moleküle der Anziehung anderer Moleküle ausgesetzt sind.
Die a- und b-Konstanten sind als empirisch zu betrachten; sie müssen aus experimentellen Daten zur Dichte-, Temperatur- und Druckinterdependenz abgeleitet werden. Für eine Reihe von technisch wichtigen Gasen sind die van-der-Waals-Konstanten tabellarisch dargestellt.
Nach der Methode, die Abweichung eines realen Gases von einem perfekten Gas zuzulassen, wäre die Van-der-Waals-Gleichung angeblich nur für kleine Abweichungen gültig, d. H. Für moderate Drücke. Es stellte sich jedoch heraus, dass diese Gleichung das reale Gasverhalten in einem breiten Parameterbereich einschließlich des kritischen Bereichs qualitativ zufriedenstellend beschreibt.
Die Van-der-Waals-Gleichung ist kubisch in Bezug auf das spezifische Volumen. Dies bedeutet, dass im Allgemeinen bei einer gegebenen Temperatur jeder Druckwert drei spezifischen Volumenwerten entspricht — ν1, ν, ν2. Die Werte ν1 und ν2 entsprechen physikalisch vorhandenen Zuständen von Flüssigkeit und Dampf. Der Wert ν, wobei (∂p /∂v)T > 0, entspricht einem instabilen Zustand und existiert physikalisch nicht. Mit zunehmender Temperatur nähern sich die Werte ν1 und ν2 an und schließlich fallen am kritischen Punkt alle drei Wurzeln am kritischen Volumen vc zusammen. Bei höheren Temperaturen bleibt nur eine Wurzel der van-der-Waals-Gleichung real, die beiden anderen imaginär. Diese überkritischen Isothermen zeigen Inflexionen bei ν = vc, die dem Verhalten realer Substanzen nahe kommen.
Für den kritischen Punkt gelten folgende Bedingungen:

und es ist möglich, mit der Van-der-Waals-Gleichung Zusammenhänge zwischen den Van-der-Waals-Konstanten und kritischen Parametern einer Substanz abzuleiten.

Daher ist der kritische Kompressibilitätsfaktor Zc für alle Substanzen identisch und gleich

In Wirklichkeit liegen die kritischen Kompressibilitätsfaktoren für die meisten Substanzen im Bereich von 0,21-0,31.
Die Van-der-Waals-Gleichung kann mit den reduzierten Parametern in eine nichtdimensionale Form gebracht werden:

In diesem Fall wird die van-der-Waals-Gleichung:

Dies bedeutet, dass bei reduzierten Parametern alle Substanzen, die der Van-der-Waals-Gleichung gehorchen, durch eine identische Zustandsgleichung beschrieben werden. Daraus folgt, dass alle diese Substanzen ähnlich behandelt werden können. Zum Beispiel haben alle Substanzen bei identischem π und τ die gleichen φ-Werte. Dieser verallgemeinerte Ansatz wird auch bei komplexeren Zustandsgleichungen verwendet, die das Verhalten realer Substanzen besser beschreiben als die Van-der-Waals-Gleichung.