L’équation DE van der Waals a été proposée en 1873. C’était une première étape vers la prise en compte des forces d’interaction qui agissent entre les molécules de gaz réels.
L’équation d’état du gaz parfait se réfère à un gaz constitué d’éléments semblables à des points qui n’interagissent pas les uns avec les autres.
Au lieu de cela, van der Waals a proposé une équation
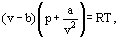
où a et b sont les constantes dites de van der Waals et qui ont des valeurs différentes pour chaque gaz.
La correction b tient compte du fait que, selon van der Waals. les molécules de gaz réelles peuvent se déplacer non pas dans le volume total occupé par le gaz, mais seulement dans une partie de ce volume qui est définie en soustrayant ce qu’il a appelé le volume propre des molécules. La correction a/ν2 – proportionnelle au carré de densité – prend en compte les forces d’attraction existant entre les molécules de gaz. Selon l’hypothèse de van der Waals, ces forces diminuent la pression contre les parois des vaisseaux, car les molécules proches de la paroi sont soumises à l’attraction d’autres molécules.
Les constantes a et b doivent être considérées comme empiriques ; elles doivent être dérivées de données expérimentales sur l’interdépendance de la densité, de la température et de la pression. Pour un certain nombre de gaz techniquement importants, les constantes de van der Waals sont tabulées.
Selon la méthode permettant de tenir compte de la déviation d’un gaz réel par rapport à un gaz parfait, l’équation de van der Waals ne serait supposée valable que pour de petites déviations, c’est-à-dire pour des pressions modérées. Mais il s’est avéré que cette équation décrit qualitativement de manière satisfaisante le comportement réel des gaz dans un large éventail de paramètres, y compris la région critique.
L’équation de van der Waals est cubique par rapport au volume spécifique. Cela signifie qu’en général à une température donnée, chaque valeur de pression correspond à trois valeurs de volume spécifiques – ν1, ν, ν2. Les valeurs ν1 et ν2 correspondent à des états physiquement existants de liquide et de vapeur. La valeur ν, où (∂p/∂v) T > 0, correspond à un état instable et n’existe pas physiquement. Au fur et à mesure que la température augmente, les valeurs ν1 et ν2 se rapprochent et finalement au point critique, les trois racines coïncident au volume critique vc. À des températures plus élevées, une seule racine de l’équation de van der Waals reste réelle, les deux autres étant imaginaires. Ces isothermes supercritiques révèlent des inflexions à ν = vc, ce qui est proche du comportement des substances réelles.
En ce qui concerne le point critique, les conditions suivantes sont valables:

et il est possible, en utilisant l’équation de van der Waals, de dériver des interconnexions entre les constantes de van der Waals et les paramètres critiques d’une substance.

Par conséquent, le facteur de compressibilité critique Zc sera identique pour toutes les substances et égal à

En réalité, les facteurs critiques de compressibilité pour la plupart des substances se situent entre 0,21 et 0,31.
L’équation de van der Waals peut être réarrangée sous une forme non dimensionnelle en utilisant les paramètres réduits:

Dans ces coordonnées, l’équation de van der Waals devient:

Cela signifie que, avec des paramètres réduits, toutes les substances obéissant à l’équation de van der Waals sont décrites par une équation d’état identique. De là, il s’ensuit que toutes ces substances peuvent être traitées de la même manière. Par exemple, à π et τ identiques, toutes les substances ont les mêmes valeurs φ. Cette approche généralisée est également utilisée avec des équations d’état plus sophistiquées qui décrivent mieux le comportement des substances réelles que l’équation de van der Waals.