a equação de van der Waals foi proposta no ano de 1873. Foi um primeiro passo para levar em conta as forças de interação que estão atuando entre moléculas de gases reais.
a equação de Estado do gás Perfeito refere-se a um gás consistindo de pontos como itens que não interagem entre si.
em vez desta equação de van der Waals
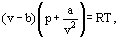
onde a e b são as chamadas constantes de van der Waals e que têm valores diferentes para cada gás.
a correção b leva em conta o fato de que, de acordo com van der Waals. as moléculas de gás real podem mover-se não no volume total ocupado pelo gás, mas apenas numa parte deste volume que é definida subtraindo o que ele chamou de volume próprio das moléculas. A correção a / ν2-proporcional ao quadrado da densidade-leva em conta as forças de atração existentes entre moléculas de gás. De acordo com a suposição de van der Waals, estas forças diminuem a pressão contra as paredes do vaso, porque as moléculas que estão perto da parede são submetidas à atração de outras moléculas.
as constantes a e b devem ser consideradas empíricas; elas devem ser derivadas de dados experimentais sobre a densidade, temperatura e interdependência de pressão. Para um número de gases tecnicamente importantes as constantes de van der Waals são tabuladas.
de acordo com o método de permitir o desvio de um gás real de um gás perfeito, a equação de van der Waals supostamente seria válida apenas para pequenos desvios, isto é, para pressões moderadas. Mas esta equação descreve qualitativamente satisfatoriamente o comportamento dos gases reais em uma ampla gama de parâmetros, incluindo a região crítica.
a equação de van der Waals é uma equação cúbica em relação ao volume específico. Isto significa que, em geral, a uma dada temperatura, cada valor de pressão corresponde a três valores de volume específicos-ν1, ν, ν2. Os valores ν1 e ν2 correspondem a Estados fisicamente existentes de líquido e vapor. O valor ν, onde (∂p/∂v)T > 0, corresponde a um estado instável e não existe fisicamente. À medida que a temperatura aumenta, os valores ν1 e ν2 se aproximam e, finalmente, no ponto crítico, todas as três raízes coincidem no volume crítico vc. A temperaturas mais altas, apenas uma raiz da equação de van der Waals permanece real, sendo as outras duas imaginárias. Estes isotérmicos supercríticos revelam inflexões em ν = vc, que está próximo do comportamento de substâncias reais.
na Medida em que o ponto crítico, as seguintes condições são válidas:

e é possível, usando a equação de van der Waals, para derivar as interconexões entre o van der Waals constantes e parâmetros críticos de uma substância.

Daí a crítica fator de compressibilidade Zc será idêntica para todas as substâncias e igual a

Na realidade, a crítica compressibilidade fatores para a maioria das substâncias caber no intervalo de 0,21-0.31.
van der Waals equação pode ser rearranjada para um nondimensional formulário usando os parâmetros reduzidos:

neste coordenadas de van der Waals equação torna-se:

Isso significa que, com menos parâmetros, todas as substâncias obedecendo a equação de van der Waals são descritos por uma idêntica equação de estado. Daqui decorre que todas estas substâncias podem ser tratadas da mesma forma. Por exemplo, em substâncias idênticas π e τ, todas as substâncias têm os mesmos valores φ. This generalized approach is used also with more sophisticated equations of state which describe the real substances behavior than the van der Waals equation.