van der Waalsin yhtälöä ehdotettiin vuonna 1873. Se oli ensimmäinen askel kohti todellisten kaasumolekyylien välillä vaikuttavien vuorovaikutusvoimien huomioimista.
täydellisen kaasun tilan yhtälöllä tarkoitetaan kaasua, joka koostuu pistekaltaisista kappaleista, jotka eivät ole vuorovaikutuksessa keskenään.
tämän sijaan van der Waals ehdotti yhtälöä
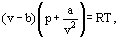
missä a ja b ovat niin sanottuja van der Waalsin vakioita ja joilla on eri arvot jokaiselle kaasulle.
B-korjauksessa otetaan van der Waalsin mukaan huomioon se, että. todelliset kaasumolekyylit eivät voi liikkua kaasun käytössä olevassa kokonaistilavuudessa, vaan vain osassa tätä tilavuutta, joka määritellään vähentämällä siitä, mitä hän kutsui molekyylien omaksi tilavuudeksi. Tiheyden neliöön suhteutettu korjaus a/ν2 ottaa huomioon kaasumolekyylien väliset vetovoimat. Van der Waalsin oletuksen mukaan nämä voimat vähentävät painetta astian seinämiä vastaan, koska seinän lähellä olevat molekyylit altistuvat muiden molekyylien vetovoimalle.
A-ja b-vakioita on pidettävä empiirisinä; ne on johdettava kokeellisista tiedoista tiheyden, lämpötilan ja paineen keskinäisestä riippuvuudesta. Useille teknisesti tärkeille kaasuille van der Waalsin vakiot on taulukoitu.
menetelmän mukaan, jolla reaalikaasu voidaan poiketa täydellisestä kaasusta, van der Waalsin yhtälö olisi oletettavasti voimassa vain pienille poikkeamille eli kohtalaisille paineille. Mutta kävi ilmi, että tämä yhtälö kuvaa laadullisesti tyydyttävästi todellisten kaasujen käyttäytymistä monilla parametreilla, mukaan lukien kriittinen alue.
van der Waalsin yhtälö on kuutiollinen tietyntilavuuden suhteen. Tämä tarkoittaa, että yleensä tietyssä lämpötilassa jokainen painearvo vastaa kolmea tiettyä tilavuusarvoa—ν1, ν, ν2. Arvot ν1 ja ν2 vastaavat fysikaalisesti olemassa olevia nesteen ja höyryn tiloja. Arvo ν, jossa (∂p / ∂v) t > 0, vastaa epävakaata tilaa eikä sitä ole fysikaalisesti olemassa. Lämpötilan noustessa arvot ν1 ja ν2 lähestyvät ja lopulta kriittisessä pisteessä kaikki kolme juurta yhtyvät kriittisessä tilavuudessa vc. Korkeammissa lämpötiloissa vain yksi juuri van der Waalsin yhtälöstä pysyy todellisena, kaksi muuta ovat kuvitteellisia. Nämä ylikriittiset isotermit paljastavat inflexions At ν = vc, joka on lähellä käyttäytymistä todellisia aineita.
kriittisessä pisteessä pätevät seuraavat ehdot:

ja van der Waalsin yhtälön avulla on mahdollista johtaa yhtymäkohtia van der Waalsin vakioiden ja aineen kriittisten parametrien välillä.

näin ollen kriittinen puristuvuuskerroin Zc on sama kaikille aineille ja yhtä suuri kuin

todellisuudessa useimpien aineiden kriittiset puristuvuuskertoimet sijoittuvat välille 0,21-0,31.
van der Waalsin yhtälö voidaan järjestää uudelleen ei-ulottuvuuteen pelkistettyjen parametrien avulla:

tässä koordinaatistossa van der Waalsin yhtälöstä tulee:

tämä tarkoittaa, että pelkistetyillä parametreilla kaikki van der Waalsin yhtälöä noudattavat aineet kuvataan identtisellä tilayhtälöllä. Tästä seuraa, että kaikkia näitä aineita voidaan käsitellä samalla tavalla. Esimerkiksi identtisissä π-Ja τ-arvoissa kaikilla aineilla on samat φ-arvot. Tätä yleistettyä lähestymistapaa käytetään myös kehittyneemmissä tilayhtälöissä, jotka kuvaavat reaaliaineiden käyttäytymistä paremmin kuin van der Waalsin yhtälö.