de Van der Waals-vergelijking werd voorgesteld in het jaar 1873. Het was een eerste stap om rekening te houden met interactiekrachten die inwerken tussen reële gasmoleculen.
de toestandsvergelijking van het perfecte gas verwijst naar een gas dat bestaat uit puntachtige elementen die niet met elkaar interageren.
in plaats van dit stelde van der Waals een vergelijking voor
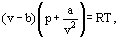
waarbij a en b de zogenaamde Van der Waals constanten zijn en die verschillende waarden hebben voor elk gas.
de B-correctie houdt rekening met het feit dat, volgens van der Waals. de echte gasmoleculen kunnen niet bewegen in het totale volume dat door het gas wordt ingenomen, maar alleen in een deel van dit volume dat wordt gedefinieerd door af te trekken wat hij de moleculen eigen volume noemde. De correctie a / ν2-evenredig aan het dichtheidsvierkant-houdt rekening met de aantrekkende krachten die tussen gasmoleculen bestaan. Volgens de aanname van Van der Waals verminderen deze krachten de druk tegen de vaatwanden, omdat de moleculen die dicht bij de wand staan, worden blootgesteld aan aantrekking van andere moleculen.
de A-en b-constanten moeten als empirisch worden beschouwd; zij moeten worden afgeleid uit experimentele gegevens over de onderlinge afhankelijkheid van dichtheid, temperatuur en druk. Voor een aantal technisch belangrijke gassen worden de Van der Waals constanten in tabelvorm weergegeven.
volgens de methode om afwijkingen van een reëel gas van een perfect gas toe te staan, zou de vergelijking van Van der Waals slechts geldig zijn voor kleine afwijkingen, d.w.z. voor matige druk. Maar het bleek dat deze vergelijking kwalitatief bevredigend het echte gasgedrag beschrijft in een breed scala van parameters, waaronder het kritieke gebied.
de vergelijking van der Waals is een kubieke met betrekking tot het specifieke volume. Dit betekent dat in het algemeen bij een bepaalde temperatuur elke drukwaarde overeenkomt met drie specifieke volumewaarden—ν1, ν, ν2. De waarden ν1 en ν2 komen overeen met de fysisch bestaande toestanden van vloeistof en damp. De waarde ν, waarbij (∂p / ∂v) T > 0 overeenkomt met een onstabiele toestand en fysiek niet bestaat. Naarmate de temperatuur stijgt, komen de waarden ν1 en ν2 dichter bij elkaar en tenslotte vallen op het kritieke punt alle drie de wortels samen bij het kritische volume vc. Bij hogere temperaturen blijft slechts één wortel van de Van der Waals-vergelijking reëel, de andere twee zijn imaginair. Deze superkritische isothermen onthullen inflexions bij ν = vc die dicht bij het gedrag van echte substanties ligt.
voor zover op het kritieke punt de volgende voorwaarden gelden:

en het is mogelijk, met behulp van de Van der Waals vergelijking, om verbindingen af te leiden tussen de Van der Waals constanten en kritische parameters van een stof.

daarom zal de kritische samendrukbaarheidsfactor Zc voor alle stoffen identiek zijn en gelijk zijn aan

in werkelijkheid passen de kritische samendrukbaarheidsfactoren voor de meeste stoffen in het bereik 0,21-0,31.
De van der Waals vergelijking kan worden omgebouwd tot een nondimensional vorm met behulp van de parameters verlaagd:

In deze coördineert de van der Waals vergelijking wordt:

Dit betekent dat, met een beperkte parameters, alle stoffen naleven van de van der Waals vergelijking worden beschreven door een identieke vergelijking van state. Hieruit volgt dat al deze stoffen op dezelfde manier kunnen worden behandeld. Zo hebben bij identieke π en τ alle stoffen dezelfde φ waarden. Deze veralgemeende benadering wordt ook gebruikt bij meer gesofisticeerde toestandsvergelijkingen die het gedrag van echte stoffen beter beschrijven dan de Van der Waals vergelijking.