a van der Waals-egyenletet 1873-ban javasolták. Ez volt az első lépés a valódi gázmolekulák közötti kölcsönhatási erők figyelembevétele felé.
a tökéletes gáz állapotának egyenlete olyan gázra vonatkozik, amely pontszerű elemekből áll, amelyek nem lépnek kölcsönhatásba egymással.
e helyett van der Waals egyenletet javasolt
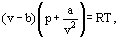
ahol a és b az úgynevezett van der Waals-állandók, amelyek értékei minden gázra eltérőek.
a B korrekció figyelembe veszi azt a tényt, hogy van der Waals szerint. a valódi gázmolekulák nem a gáz által elfoglalt teljes térfogatban mozoghatnak, hanem csak ennek a térfogatnak egy részében, amelyet úgy határozunk meg, hogy kivonjuk azt, amit a molekulák saját térfogatának nevezett. A korrekció a / 62 —a sűrűség négyzetével arányos-figyelembe veszi a gázmolekulák között fennálló vonzási erőket. Van der Waals feltételezése szerint ezek az erők csökkentik az érfalak elleni nyomást, mert a falhoz közeli molekulákat más molekulák vonzják.
az A és b állandókat empirikusnak kell tekinteni; ezeket a sűrűség, hőmérséklet és nyomás kölcsönös függőségére vonatkozó kísérleti adatokból kell levezetni. Számos technikailag fontos gáz esetében a Van der Waals-állandók táblázatosak.
a Van der Waals-egyenlet a valódi gáz tökéletes gáztól való eltérésének lehetővé tételének módszere szerint állítólag csak kis eltérésekre, azaz mérsékelt nyomásokra érvényes. De kiderült, hogy ez az egyenlet minőségileg kielégítően leírja a gázok valós viselkedését számos paraméterben, beleértve a kritikus régiót is.
a van der Waals-egyenlet köbös a fajlagos térfogat tekintetében. Ez azt jelenti, hogy általában egy adott hőmérsékleten minden nyomásérték három fajlagos térfogatértéknek felel meg – ~ 1,~, ~ 2. A (6) és (2) érték a fizikailag létező folyadék-és gőzállapotoknak felel meg. Az érték, ahol (o/v)t > 0, instabil állapotnak felel meg, és fizikailag nem létezik. Ahogy a hőmérséklet emelkedik, az értékek a 61 és a 2 egyre közelebb kerülnek, és végül a kritikus ponton mindhárom gyökér egybeesik a kritikus VC térfogatnál. Magasabb hőmérsékleten a van der Waals-egyenletnek csak egy gyökere marad valós, a másik kettő képzeletbeli. Ezek a szuperkritikus izotermák inflexiókat tárnak fel a (Z) – nél 6 = vc, amely közel áll a valódi anyagok viselkedéséhez.
a kritikus ponton a következő feltételek érvényesek:

és lehetséges a van der Waals-egyenlet segítségével a Van der Waals-állandók és az anyag kritikus paraméterei közötti összefüggések levezetése.

ezért a ZC kritikus összenyomhatósági tényező minden anyag esetében azonos és egyenlő

a valóságban a legtöbb anyag kritikus összenyomhatósági tényezői a 0,21-0,31 tartományba esnek.
a Van der Waals-egyenlet a csökkentett paraméterek segítségével nem dimenziós formába rendezhető:

ebben a koordinátákban a van der Waals-egyenlet válik:

ez azt jelenti, hogy csökkentett paraméterekkel a van der Waals-egyenletnek engedelmeskedő összes anyagot azonos állapotegyenlet írja le. Innen következik, hogy ezeket az anyagokat hasonlóan lehet kezelni. Például, ha az anyag azonos, akkor az összes anyag ugyanazokkal az értékekkel rendelkezik. Ezt az általánosított megközelítést kifinomultabb állapotegyenletekkel is alkalmazzák, amelyek jobban leírják a valós anyagok viselkedését, mint a van der Waals-egyenlet.