ecuația van der Waals a fost propusă în anul 1873. A fost un prim pas spre luarea în considerare a forțelor de interacțiune care acționează între moleculele de gaze reale.
ecuația stării gazului perfect se referă la un gaz format din elemente asemănătoare punctelor care nu interacționează între ele.
în loc de aceasta, van der Waals a propus o ecuație
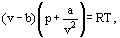
unde a și b sunt așa-numitele constante van der Waals și care au valori diferite pentru fiecare gaz.
corecția b ia în considerare faptul că, potrivit lui van der Waals. moleculele reale de gaz se pot deplasa nu în volumul total ocupat de gaz, ci doar într-o parte din acest volum care este definit prin scăderea a ceea ce el a numit volumul propriu al moleculelor. Corecția a / inkts2-proporțională cu pătratul densității-ia în considerare forțele de atracție existente între moleculele de gaz. Conform presupunerii van der Waals, aceste forțe scad presiunea asupra pereților vaselor, deoarece moleculele care sunt aproape de perete sunt supuse atracției altor molecule.
constantele a și b trebuie considerate empirice; ele trebuie derivate din date experimentale privind interdependența densității, temperaturii și presiunii. Pentru o serie de gaze importante din punct de vedere tehnic, constantele van der Waals sunt tabelate.
conform metodei de a permite abaterea unui gaz real de la un gaz perfect, ecuația van der Waals ar fi valabilă doar pentru abateri mici, adică pentru presiuni moderate. Dar sa dovedit că această ecuație descrie calitativ în mod satisfăcător comportamentul gazelor reale într-o gamă largă de parametri, inclusiv regiunea critică.
ecuația van der Waals este una cubică în raport cu volumul specific. Aceasta înseamnă că, în general, la o temperatură dată, fiecare valoare a presiunii corespunde a trei valori specifice ale volumului—. Valorile x1 și X2 corespund stărilor de lichid și vapori existente fizic. Valoarea XL, unde (XlX p / XlX v) T > 0, corespunde unei stări instabile și nu există fizic. Pe măsură ce temperatura crește, valorile xc1 și xc2 se apropie și, în final, la punctul critic, toate cele trei rădăcini coincid la volumul critic vc. La temperaturi mai ridicate, o singură rădăcină a ecuației van der Waals rămâne reală, celelalte două fiind imaginare. Aceste izoterme supercritice relevă inflexiuni la XV = vc care este aproape de comportamentul substanțelor reale.
în ceea ce privește punctul critic, sunt valabile următoarele condiții:

și este posibil, folosind ecuația van der Waals, să se obțină interconexiuni între constantele van der Waals și parametrii critici ai unei substanțe.

prin urmare, factorul critic de compresibilitate Zc va fi identic pentru toate substanțele și egal cu

în realitate, factorii critici de compresibilitate pentru majoritatea substanțelor se încadrează în intervalul 0,21-0,31.
ecuația van der Waals poate fi rearanjată într-o formă nedimensională folosind parametrii reduși:

în aceste coordonate ecuația van der Waals devine:

aceasta înseamnă că, cu parametri reduși, toate substanțele care respectă ecuația van der Waals sunt descrise printr-o ecuație de stare identică. De aici rezultă că toate aceste substanțe pot fi tratate în mod similar. De exemplu, la aceleași valori ca și la aceleași valori ca și la aceleași valori ca și la aceleași valori ca și la aceleași valori ca și la aceleași valori. Această abordare generalizată este utilizată și cu ecuații de stare mai sofisticate care descriu comportamentul substanțelor reale mai bine decât ecuația van der Waals.