L’equazione di van der Waals fu proposta nel 1873. Si è trattato di un primo passo verso la presa in considerazione delle forze di interazione che agiscono tra molecole di gas reali.
L’equazione di stato del gas perfetto si riferisce a un gas costituito da elementi puntiformi che non interagiscono tra loro.
Invece di questo van der Waals propose un’equazione
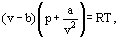
dove a e b sono le cosiddette costanti di van der Waals e che hanno valori diversi per ciascun gas.
La correzione b tiene conto del fatto che, secondo van der Waals. le molecole di gas reali possono muoversi non nel volume totale occupato dal gas, ma solo in una parte di questo volume che è definito sottraendo quello che ha chiamato le molecole proprio volume. La correzione a / ν2-proporzionale al quadrato di densità-tiene conto delle forze di attrazione esistenti tra le molecole di gas. Secondo l’ipotesi di van der Waals, queste forze diminuiscono la pressione contro le pareti dei vasi, perché le molecole che sono vicine alla parete sono soggette all’attrazione di altre molecole.
Le costanti a e b sono da considerarsi empiriche; devono essere ricavate da dati sperimentali sull’interdipendenza di densità, temperatura e pressione. Per un certo numero di gas tecnicamente importanti le costanti di van der Waals sono tabulate.
Secondo il metodo di consentire la deviazione di un gas reale da un gas perfetto, l’equazione di van der Waals sarebbe valida solo per piccole deviazioni, cioè per pressioni moderate. Ma si è scoperto che questa equazione descrive qualitativamente in modo soddisfacente il comportamento reale dei gas in una vasta gamma di parametri, inclusa la regione critica.
L’equazione di van der Waals è cubica rispetto al volume specifico. Ciò significa che in generale a una data temperatura, ogni valore di pressione corrisponde a tre valori di volume specifici: ν1, ν, ν2. I valori ν1 e ν2 corrispondono agli stati fisicamente esistenti di liquido e vapore. Il valore ν, dove (p p/v v)T > 0, corrisponde a uno stato instabile e non esiste fisicamente. All’aumentare della temperatura, i valori ν1 e ν2 si avvicinano e infine nel punto critico tutte e tre le radici coincidono al volume critico vc. A temperature più elevate solo una radice dell’equazione di van der Waals rimane reale, le altre due sono immaginarie. Queste isoterme supercritiche rivelano inflessioni a ν = vc che è vicino al comportamento delle sostanze reali.
Per quanto riguarda il punto critico, sono valide le seguenti condizioni:

ed è possibile, usando l’equazione di van der Waals, ricavare interconnessioni tra le costanti di van der Waals e i parametri critici di una sostanza.

Quindi il fattore critico di compressibilità Zc sarà identico per tutte le sostanze e uguale a

In realtà i fattori critici di compressibilità per la maggior parte delle sostanze rientrano nell’intervallo 0,21-0,31.
L’equazione di van der Waals può essere riorganizzato per un fattore correttivo globale, adimensionale modulo utilizzando il ridotto parametri:

In questo le coordinate di van der Waals equazione diventa:

Questo significa che, con una riduzione dei parametri, tutte le sostanze obbedire l’equazione di van der Waals sono descritte da un identico equazione di stato. Da qui ne consegue che tutte queste sostanze possono essere trattate allo stesso modo. Ad esempio, a π e τ identici tutte le sostanze hanno gli stessi valori φ. Questo approccio generalizzato viene utilizzato anche con equazioni di stato più sofisticate che descrivono il comportamento delle sostanze reali meglio dell’equazione di van der Waals.