ファンデルワールス状態方程式は1873年に提案されました。 これは、実際のガス分子間で作用している相互作用力を考慮に入れるための最初のステップでした。
完全ガスの状態方程式は、互いに相互作用しない点のような項目からなるガスを指します。
この代わりに、ファンデルワールスは方程式を提案した
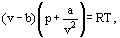
ここで、aおよびbは、いわゆるファンデルワールス定数であり、各ガスに対して異なる値を有する。
b補正は、van der Waalsによると、という事実を考慮に入れています。 実際のガス分子は、ガスが占める総体積ではなく、彼が分子自身の体積と呼んだものを差し引くことによって定義されるこの体積の一部でしか動 密度の二乗に比例する補正a/λ2は、ガス分子間に存在する引力を考慮に入れます。 ファンデルワールスの仮定によれば、これらの力は、壁に近い分子が他の分子の引力を受けるため、容器壁に対する圧力を減少させる。
a定数とb定数は経験的なものとみなされ、密度、温度、圧力の相互依存性に関する実験データから導出されなければなりません。 多くの技術的に重要なガスについて,vanderwaals定数を表にした。
完全ガスからの実ガスの偏差を可能にする方法によれば、ファンデルワールス方程式は、小さな偏差、すなわち中圧に対してのみ有効であると思われる。 しかし,この方程式は臨界領域を含む広い範囲のパラメータにおける実際のガス挙動を定性的に良好に記述することが分かった。
ファンデルワールス方程式は、特定の体積に対する立方方程式です。 これは、一般に、所与の温度において、各圧力値は、3つの特定の体積値−θ1、θ、θ2に対応することを意味する。 値θ1およびθ2は、液体および蒸気の物理的に存在する状態に対応する。 値λ(ここで、(λ p/λ v)T>0)は不安定な状態に対応し、物理的には存在しません。 温度が上昇するにつれて、値θ1とθ2はより近くなり、最終的に臨界点で三つの根はすべて臨界体積vcで一致します。 より高い温度では、ファンデルワールス方程式の1つの根だけが実数のままであり、他の2つは虚数である。 これらの超臨界等温線は、実際の物質の挙動に近いσ=vcでの屈曲を明らかにする。
臨界点においては、以下の条件が有効である:

また,vanderwaals方程式を用いて,vanderwaals定数と物質の臨界パラメータとの間の相互接続を導出することが可能である。

したがって、臨界圧縮率係数Zcはすべての物質に対して同一であり、次のように等しくなります。

実際にはほとんどの物質のための重大な圧縮率の要因は範囲0.21-0.31に合いました。
ファンデルワールス方程式は、縮小されたパラメータを使用して無次元形式に再配置することができます:

この座標では、ファンデルワールス方程式は次のようになります:

これは、パラメータが減少すると、ファンデルワールス方程式に従うすべての物質が同一の状態方程式によって記述されることを意味する。 ここから、これらの物質はすべて同様に処理することができることになる。 例えば、同一のσおよびσにおいて、すべての物質は同じφ値を有する。 この一般化されたアプローチは,vanderwaals方程式よりも実際の物質の挙動をよりよく記述するより洗練された状態方程式でも使用される。