van Der Waals ligningen ble foreslått i år 1873. Det var et første skritt mot å ta hensyn til interaksjonskrefter som virker mellom virkelige gassmolekyler.
tilstandsligningen for den perfekte gass refererer til en gass som består av punktlignende elementer som ikke interagerer med hverandre.
I Stedet for denne van Der Waals foreslo en ligning
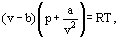
hvor a og b er de såkalte van Der Waals-konstantene og som har forskjellige verdier for hver gass.
b-korreksjonen tar hensyn til det faktum at, ifølge van Der Waals. de virkelige gassmolekylene kan ikke bevege seg i det totale volumet okkupert av gassen, men bare i en del av dette volumet som er definert ved å trekke fra det han kalte molekylene eget volum. Korreksjonen a/ν 2-proporsjonal med kvadratet av tetthet-tar hensyn til tiltrekningskreftene som eksisterer mellom gassmolekyler. Ifølge van Der Waals-antagelsen reduserer disse kreftene trykket mot fartøyets vegger, fordi molekylene som er nær veggen, blir utsatt for tiltrekning av andre molekyler.
a-og b-konstantene skal betraktes som empiriske; de må avledes fra eksperimentelle data om tetthet, temperatur og trykkavhengighet. For en rekke teknisk viktige gasser er van Der Waals konstanter tabulert.
ifølge metoden for å tillate avvik av en ekte gass fra en perfekt gass, ville van Der Waals-ligningen bare være gyldig for små avvik, dvs.for moderat trykk. Men det viste seg at denne ligningen kvalitativt tilfredsstillende beskriver den virkelige gassadferden i et bredt spekter av parametere, inkludert den kritiske regionen.
van Der Waals-ligningen er en kubisk med hensyn til det spesifikke volumet. Det betyr at hver trykkverdi generelt ved en gitt temperatur tilsvarer tre spesifikke volumverdier—ν1, ν, ν 2. Verdiene ν 1 og ν2 tilsvarer fysisk eksisterende tilstander av væske og damp. Verdien ν, der (∂p / ∂v)t > 0, tilsvarer en ustabil tilstand og eksisterer ikke fysisk. Etter hvert som temperaturen øker, kommer verdiene ν 1 og ν 2 nærmere og til slutt på det kritiske punktet sammenfaller alle tre røttene ved det kritiske volumet vc. Ved høyere temperaturer forblir bare en rot av van Der Waals-ligningen ekte, de to andre er imaginære. Disse superkritiske isotermene avslører inflexions ved ν = vc som er nær oppførselen til virkelige stoffer.
så langt som på det kritiske punktet er følgende betingelser gyldige:

og det er mulig, ved hjelp av van Der Waals-ligningen, å utlede sammenkoblinger mellom van Der Waals-konstantene og kritiske parametere av et stoff.

derfor vil den kritiske kompressibilitetsfaktoren Zc være identisk for alle stoffer og lik

i virkeligheten passer de kritiske kompressibilitetsfaktorene for de fleste stoffer inn i området 0,21-0,31.
van Der Waals-ligningen kan omarrangeres til en ikke-dimensjonal form ved hjelp av de reduserte parametrene:

i dette koordinatene van Der Waals ligningen blir:

Dette betyr at med reduserte parametere beskrives alle stoffer som adlyder van Der Waals-ligningen ved en identisk tilstandsligning. Herfra følger det at alle disse stoffene kan behandles på samme måte. For eksempel har alle substansene de samme φ ved identiske π. Denne generaliserte tilnærmingen brukes også med mer sofistikerte tilstandsligninger som beskriver den virkelige substansadferden bedre enn van Der Waals-ligningen.