równanie van der Waalsa zaproponowano w roku 1873. Był to pierwszy krok w kierunku uwzględnienia sił oddziaływań działających pomiędzy cząsteczkami gazów rzeczywistych.
równanie stanu gazu doskonałego odnosi się do gazu składającego się z punktów, które nie oddziałują ze sobą.
zamiast tego van der Waals zaproponował równanie
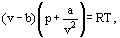
gdzie A i b są tak zwanymi stałymi van der Waalsa i które mają różne wartości dla każdego gazu.
korekta b uwzględnia fakt, że według van der Waalsa. rzeczywiste cząsteczki gazu mogą poruszać się nie w całkowitej objętości zajmowanej przez gaz, ale tylko w części tej objętości, która jest określona przez odjęcie tego, co nazwał własną objętością cząsteczek. Korekta a / ν2-proporcjonalna do kwadratu gęstości-uwzględnia siły przyciągania istniejące między cząsteczkami gazu. Zgodnie z założeniem van der Waalsa siły te zmniejszają nacisk na ściany naczynia, ponieważ cząsteczki znajdujące się blisko ściany są poddawane przyciąganiu innych cząsteczek.
stałe a i b należy traktować jako empiryczne; muszą one pochodzić z danych doświadczalnych dotyczących zależności gęstości, temperatury i ciśnienia. Dla wielu ważnych technicznie gazów stałe van der Waalsa są tabelaryczne.
zgodnie z metodą pozwalającą na odchylenie gazu rzeczywistego od gazu doskonałego, równanie van der Waalsa przypuszczalnie byłoby ważne tylko dla małych odchyleń, tj. dla umiarkowanych ciśnień. Okazało się jednak, że to równanie jakościowo zadowalająco opisuje zachowanie się gazów rzeczywistych w szerokim zakresie parametrów, w tym w obszarze krytycznym.
równanie van der Waalsa jest sześcienne względem objętości właściwej. Oznacza to, że ogólnie w danej temperaturze każdej wartości ciśnienia odpowiadają trzy wartości objętości właściwej—ν1, ν, ν2. Wartości ν1 i ν2 odpowiadają fizycznie istniejącym stanom cieczy i pary. Wartość ν, gdzie (∂p / ∂v) t > 0, odpowiada stanowi niestabilnemu i nie istnieje fizycznie. Wraz ze wzrostem temperatury wartości ν1 i ν2 zbliżają się i wreszcie w punkcie krytycznym wszystkie trzy korzenie zbiegają się w objętości krytycznej vc. W wyższych temperaturach tylko jeden pierwiastek równania van der Waalsa pozostaje rzeczywisty, a dwa pozostałe są urojone. Te nadkrytyczne izotermy ujawniają niepleksy przy ν = vc, które są zbliżone do zachowania rzeczywistych substancji.
w punkcie krytycznym obowiązują następujące warunki:

za pomocą równania van der Waalsa możliwe jest wyprowadzenie wzajemnych powiązań między stałymi van der Waalsa a krytycznymi parametrami substancji.

dlatego krytyczny współczynnik ściśliwości Zc będzie identyczny dla wszystkich substancji i równy

w rzeczywistości krytyczne współczynniki ściśliwości dla większości substancji mieszczą się w zakresie 0,21-0,31.
równanie van der Waalsa można przestawić do postaci niewymiarowej za pomocą zredukowanych parametrów:

we współrzędnych tych równanie van der Waalsa staje się:

oznacza to, że przy zredukowanych parametrach wszystkie substancje spełniające równanie van der Waalsa są opisane identycznym równaniem stanu. Stąd wynika, że wszystkie te substancje mogą być traktowane podobnie. Na przykład przy identycznych π i τ wszystkie substancje mają te same wartości φ. To uogólnione podejście jest również używane z bardziej wyrafinowanymi równaniami stanu, które opisują zachowanie rzeczywistych substancji lepiej niż równanie van der Waalsa.