van der Waalsova rovnice byla navržena v roce 1873. Byl to první krok k zohlednění interakčních sil, které působí mezi molekulami reálných plynů.
rovnice stavu dokonalého plynu se týká plynu sestávajícího z bodových položek, které spolu neinteragují.
Namísto této van der Waalsovy navrhované rovnice
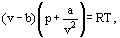
kde a a b jsou tzv. van der Waalsovy konstanty a, které mají různé hodnoty pro každý plyn.
Oprava b bere v úvahu skutečnost, že podle van der Waalse. skutečné molekuly plynu se mohou pohybovat ne v celkovém objemu obsazeném plynem, ale pouze v části tohoto objemu, která je definována odečtením toho, co nazýval molekuly vlastní objem. Korekce a / ν2-úměrná čtverci hustoty-bere v úvahu přitažlivé síly existující mezi molekulami plynu. Podle van der Waalsovy předpokladu, že tyto síly snižují tlak proti stěnám nádoby, protože molekuly, které jsou blízko ke zdi jsou vystaveny přitažlivosti jiných molekul.
konstanty a A b se považují za empirické; musí být odvozeny z experimentálních údajů o vzájemné závislosti hustoty, teploty a tlaku. Pro řadu technicky důležitých plynů jsou van der Waalsovy konstanty uvedeny v tabulce.
Podle metody umožňující odchylku reálného plynu od ideální plyn, van der Waalsova rovnice údajně by být platné pouze pro malé odchylky, tj., pro střední tlaky. Ukázalo se však, že tato rovnice kvalitativně uspokojivě popisuje skutečné chování plynů v široké škále parametrů včetně kritické oblasti.
van der Waalsova rovnice je kubická vzhledem ke specifickému objemu. To znamená, že obecně při dané teplotě odpovídá každá hodnota tlaku třem specifickým objemovým hodnotám-ν1, ν, ν2. Hodnoty ν1 a ν2 odpovídají fyzicky existujícím stavům kapaliny a páry. Hodnota ν, kde (∂p / v v) t > 0 odpovídá nestabilnímu stavu a fyzicky neexistuje. Jak se teplota zvyšuje, hodnoty ν1 a ν2 se přibližují a nakonec v kritickém bodě se všechny tři kořeny shodují v kritickém objemu vc. Při vyšších teplotách zůstává skutečný pouze jeden kořen van der Waalsovy rovnice, další dva jsou imaginární. Tyto superkritické izotermy odhalují inflexe na ν = vc, což je blízké chování skutečných látek.
Tak daleko, jako v kritickém bodě, následující podmínky jsou platné:

a to je možné, s použitím van der Waalsovy rovnice, odvození propojení mezi van der Waalsovy konstanty a kritické parametry látky.

Proto kritické stlačitelnost faktor Zc bude shodný pro všechny látky a rovna

V reality kritické stlačitelnost faktory pro většinu látek, které se vešly do rozmezí 0.21-je 0,31.
van der Waalsovy rovnice lze upravit na nondimensional formulář pomocí snížené parametry:

V tomto souřadnice van der Waalsovy rovnice se stává:

To znamená, že, s omezenou parametry, všechny látky, poslouchat van der Waalsovy rovnice jsou popsány pomocí stejné rovnice stavu. Z toho vyplývá, že se všemi těmito látkami lze zacházet podobně. Například při identických π a τ mají všechny látky stejné hodnoty φ. Tento zobecněný přístup se používá také u sofistikovanějších stavových rovnic, které popisují chování reálných látek lépe než van der Waalsova rovnice.