van der Waals ekvation föreslogs år 1873. Det var ett första steg mot att ta hänsyn till interaktionskrafter som verkar mellan verkliga gasmolekyler.
statsekvationen för den perfekta gasen avser en gas som består av punktliknande föremål som inte interagerar med varandra.
istället för detta föreslog van der Waals en ekvation
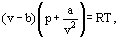
där a och b är de så kallade van der Waals-konstanterna och som har olika värden för varje gas.
B-korrigeringen tar hänsyn till det faktum att enligt van der Waals. de verkliga gasmolekylerna kan inte röra sig i den totala volymen som upptas av gasen, utan bara i en del av denna volym som definieras genom att subtrahera det han kallade molekylernas egen volym. Korrigeringen a / XX2 —proportionell mot kvadraten av densitet-tar hänsyn till de attraktionskrafter som finns mellan gasmolekyler. Enligt van der Waals-antagandet minskar dessa krafter trycket mot kärlväggarna, eftersom molekylerna som ligger nära väggen utsätts för attraktion av andra molekyler.
A-och b-konstanterna ska betraktas som empiriska; de måste härledas från experimentella data om densitet, temperatur och tryck ömsesidigt beroende. För ett antal tekniskt viktiga gaser är van der Waals konstanter tabellerade.
enligt metoden att tillåta avvikelse från en verklig gas från en perfekt gas, skulle van der Waals-ekvationen förmodligen vara giltig endast för små avvikelser, dvs för måttliga tryck. Men det visade sig att denna ekvation kvalitativt tillfredsställande beskriver det verkliga gasbeteendet i ett brett spektrum av parametrar inklusive den kritiska regionen.
van der Waals-ekvationen är en kubisk med avseende på den specifika volymen. Detta innebär att i allmänhet vid en given temperatur motsvarar varje tryckvärde tre specifika volymvärden-2, 1, 2, 2. Värdena 21 och 22 motsvarar fysiskt existerande tillstånd av vätska och ånga. Värdet av den, där (p/v / b / b)t > 0, motsvarar ett instabilt tillstånd och existerar inte fysiskt. När temperaturen ökar, kommer värdena 2-1 och 2 närmare och slutligen vid den kritiska punkten sammanfaller alla tre rötterna vid den kritiska volymen vc. Vid högre temperaturer förblir endast en rot av van der Waals-ekvationen verklig, de två andra är imaginära. Dessa superkritiska isotermer avslöjar inflexioner vid Bisexuell = vc som ligger nära beteendet hos verkliga ämnen.
så långt som vid den kritiska punkten är följande villkor giltiga:

och det är möjligt att använda van der Waals-ekvationen för att härleda sammankopplingar mellan van der Waals-konstanterna och kritiska parametrar för ett ämne.

därför kommer den kritiska komprimeringsfaktorn Zc att vara identisk för alla ämnen och lika med

i verkligheten passar de kritiska komprimeringsfaktorerna för de flesta ämnen i intervallet 0,21-0,31.
van der Waals-ekvationen kan ordnas om till en icke-dimensionell form med hjälp av de reducerade parametrarna:

i detta koordinater blir van der Waals ekvation:

Detta innebär att med reducerade parametrar beskrivs alla ämnen som följer van der Waals-ekvationen med en identisk tillståndsekvation. Härifrån följer att alla dessa ämnen kan behandlas på samma sätt. Till exempel har alla ämnen samma värden på samma nivå som på samma nivå som på samma nivå som på samma nivå som på samma nivå som på samma nivå som på samma nivå. Detta generaliserade tillvägagångssätt används också med mer sofistikerade tillståndsekvationer som beskriver det verkliga ämnenas beteende bättre än van der Waals-ekvationen.