La ecuación de VAN der Waals fue propuesta en el año 1873. Fue un primer paso para tener en cuenta las fuerzas de interacción que actúan entre moléculas de gases reales.
La ecuación de estado del gas perfecto se refiere a un gas que consiste en elementos similares a puntos que no interactúan entre sí.
En lugar de esto, van der Waals propuso una ecuación
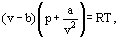
donde a y b son las llamadas constantes de van der Waals y que tienen valores diferentes para cada gas.
La corrección b tiene en cuenta el hecho de que, según van der Waals. las moléculas de gas reales no pueden moverse en el volumen total ocupado por el gas, sino solo en una parte de este volumen que se define restando lo que él llamó el volumen propio de las moléculas. La corrección a / ν2 —proporcional al cuadrado de densidad-tiene en cuenta las fuerzas de atracción existentes entre las moléculas de gas. De acuerdo con la suposición de van der Waals, estas fuerzas disminuyen la presión contra las paredes de los vasos, porque las moléculas que están cerca de la pared están sujetas a la atracción de otras moléculas.
Las constantes a y b deben considerarse empíricas; deben derivarse de datos experimentales sobre la interdependencia de densidad, temperatura y presión. Para una serie de gases técnicamente importantes, se tabulan las constantes de van der Waals.
De acuerdo con el método de permitir la desviación de un gas real de un gas perfecto, la ecuación de van der Waals supuestamente sería válida solo para desviaciones pequeñas, es decir, para presiones moderadas. Pero resultó que esta ecuación describe cualitativamente satisfactoriamente el comportamiento real de los gases en una amplia gama de parámetros, incluida la región crítica.
La ecuación de van der Waals es cúbica con respecto al volumen específico. Esto significa que, en general, a una temperatura dada, cada valor de presión corresponde a tres valores de volumen específicos: ν1, ν, ν2. Los valores ν1 y ν2 corresponden a estados físicamente existentes de líquido y vapor. El valor ν, donde (∂p / ∂v) T > 0, corresponde a un estado inestable y no existe físicamente. A medida que aumenta la temperatura, los valores ν1 y ν2 se acercan y, finalmente, en el punto crítico, las tres raíces coinciden en el volumen crítico vc. A temperaturas más altas, solo una raíz de la ecuación de van der Waals permanece real, las otras dos son imaginarias. Estas isotermas supercríticas revelan inflexiones en ν = vc que se aproximan al comportamiento de sustancias reales.
En la medida en que se encuentre en el punto crítico, las siguientes condiciones son válidas:

y es posible, usando la ecuación de van der Waals, derivar interconexiones entre las constantes de van der Waals y los parámetros críticos de una sustancia.

Por lo tanto, el factor de compresibilidad crítico Zc será idéntico para todas las sustancias e igual a

En realidad, los factores de compresibilidad críticos para la mayoría de las sustancias encajan en el rango de 0,21 a 0,31.
La ecuación de van der Waals se puede reorganizar a una forma no dimensional utilizando los parámetros reducidos:

En estas coordenadas la ecuación de van der Waals se convierte en:

Esto significa que, con parámetros reducidos, todas las sustancias que obedecen a la ecuación de van der Waals se describen mediante una ecuación de estado idéntica. De aquí se deduce que todas estas sustancias pueden tratarse de manera similar. Por ejemplo, en π y τ idénticos, todas las sustancias tienen los mismos valores φ. Este enfoque generalizado se utiliza también con ecuaciones de estado más sofisticadas que describen el comportamiento de las sustancias reales mejor que la ecuación de van der Waals.